Informaciones Psiquiátricas - Tercer trimestre 2002. Número 169
Factores de riesgo en la esquizofrenia
José Manuel Martínez
Rodríguez
Director Médico del Centro Hospitalario Benito Menni. Valladolid.
Recepción: 09-04-02 / Aceptación: 29-04-02
INTRODUCCIÓN
La mayor parte de las enfermedades no son ni puramente genéticas ni puramente ambientales, sino que dependen de una compleja interacción entre ambas clases de factores. La búsqueda e identificación de factores de riesgo es fundamental a estos efectos y en la actualidad la epidemiología dispone de técnicas aplicables tanto a la investigación genética como de los factores ambientales en la génesis de la esquizofrenia. En último término la identificación de riesgos permitiría elaborar estrategias preventivas, y ese habría de ser el sentido último de su búsqueda: la identificación de factores con valor predictivo que permitan prevenir o interrumpir precozmente el desarrollo de la esquizofrenia.
La nueva epidemiología psiquiátrica apunta a convertirse en una disciplina que elabora las herramientas metodológicas que puedan ser aplicadas en cualquier área de investigación en la que la pregunta y la respuesta han de formularse en términos de grupos o poblaciones más que en términos de individuos (Jones y Cannon, 1998). El interés primordial de esta disciplina no sólo apunta a responder a las preguntas de la epidemiología psiquiátrica clásica ¿quién? ¿cuándo? y ¿dónde?, sino también a identificar el ¿por qué? ¿cómo puede prevenirse? y ¿cómo puede tratarse?
CONCEPTO DE RIESGO. MÉTODOS DE INVESTIGACIÓN DE RIESGOS
La epidemiología ha utilizado tradicionalmente el estudio del riesgo como uno de los indicadores cuantitativos de una asociación causal (Jenicek y Cléroux, 1987). El riesgo es la probabilidad mayor o menor de que un suceso acaezca en función de otros. Es una medida probabilística, y por tanto, un número. Las cifras de riesgo relativo son impersonales (Price, 1995) y establecidas en función de cálculos y estrategias poblacionales. En este contexto el riesgo de esquizofrenia es la probabilidad de padecer esquizofrenia en función de distintos sucesos en una población dada.
Se denominan Factores de riesgo a todos y cada uno de los fenómenos de los que depende la probabilidad de sufrir esquizofrenia, o que están asociados a ella. Pueden ser fenómenos biológicos, psicológicos o sociales que anteceden de algún modo a la enfermedad. Pueden ser causa de la misma o simplemente estar relacionados con su causa. Hay que distinguir de esta manera los factores de riesgo que muestran simplemente una asociación estadística con la esquizofrenia de los que realmente son causales (Van Os, 1998). Solamente deberían considerarse como factores de riesgo causales aquéllos mediante la manipulación de los cuales se consigue reducir la incidencia de la enfermedad. Así, los genes en sí mismos no son causales, más bien los productos enzimáticos o los receptores neuronales, que sí pueden ser manipulados, son factores de riesgo causales.
Los factores de riesgo causales han de diferenciarse también de los marcadores de riesgo. Así, por ejemplo, la elevación de la Gamma-Glutamil-Transpeptidasa (GGT) ha demostrado comportarse como un factor de riesgo predictivo de las diversas patologías asociadas con el alcoholismo crónico (Kristenson y Johnell, 1985). Sin embargo la elevación de la GGT es simplemente un marcador de riesgo del abuso de alcohol, que es el verdadero factor de riesgo causal. En realidad la elevación de la GGT es un buen indicador biológico del aumento de la actividad enzimática microsomal inducida por el alcohol, volviendo rápidamente a la normalidad tras la abstinencia.
De forma similar se ha propuesto como marcador de riesgo genético en el caso de la Esquizofrenia el aumento de los ventrículos cerebrales, entre otros marcadores que vamos a comentar a continuación. Para muchos de ellos resultan pertinentes estas reflexiones, ya que las posibilidades de prevención sólo pueden venir de la identificación de factores de riesgo causales. Las características que han de cumplir los fenómenos propuestos como Marcadores de riesgo en la esquizofrenia han sido bien descritos por Keshavan y Sharma (tabla I). En la última década se han propuesto los siguientes:

- Déficits atencionales. Tanto los hijos como los hermanos de los pacientes esquizofrénicos presentan déficits atencionales muchos años antes del inicio de los síntomas esquizofrénicos (Erlenmayer-Kimling y Cornblatt, 1987; Mednick, S.A. y cols., 1987; Maier y cols., 1992; Kremen y cols., 1994). Jones y cols. (1994) y Crow y cols. (1995) han mostrado en estudios prospectivos longitudinales como los niños que desarrollarán esquizofrenia presentan trastornos para la lectura y las matemáticas a los ocho años. También Cornblatt (1994) ha mostrado cómo se asocia al desarrollo ulterior de Esquizofrenia un rendimiento deficiente en el Perfomance Continuous Test, una prueba que valora la capacidad del sujeto para responder a un estímulo diana o a una secuencia de estímulos al tiempo que ignora la información previamente calificada como irrelevante. También Freedman y cols. (1998) tras el estudio de una cohorte de niños en riesgo para la Esquizofrenia muestran como los trastornos en la atención parecen ser un indicador neurobiológico de ulterior psicopatología. Recientemente se ha realizado una modificación del Continuous Performance Test para poder utilizarlo ampliamente como potencial marcador de la vulnerabilidad a la Esquizofrenia (Chen y cols., 1998). Por otra parte Suhr (1997) ha mostrado cómo un grupo de niños de alto riesgo, aunque no mostraban un déficit cognitivo generalizado, sufrían deterioros en tests de funciones ejecutivas, en comparación con estudiantes controles, utilizando el Wisconsin Card Sorting Test, el Strop Color y el Word Test. Los resultados sugieren que en individuos que están en riesgo de sufrir esquizofrenia aparecen déficits en el control inhibitorio.
- Alteración en la habituación de la actividad electrodermal. Ha sido propuesto como marcador de riesgo para la esquizofrenia (Hollister y cols., 1994). Recientemente Ohman y Hultman (1998), han descrito cómo los pacientes esquizofrénicos que han sufrido muchas complicaciones obstétricas tienen menores niveles de actividad electrodérmica. Esta asociación fue más elevada para la frecuencia de respuestas de conductancia cutánea en las mujeres que en los hombres. Estos resultados se interpretan como alteraciones en el neurodesarrollo resultado de anormalidades cerebrales que interfieren con la actividad electrodérmica.
- Potenciales evocados: En los familiares de los esquizofrénicos se ha demostrado una amplitud reducida y una latencia prolongada de los componentes P50, P300 y N100, habiendo sido propuestos como indicadores de riesgo de Esquizofrenia (Friedman y cols., 1994; Frangou y cols., 1997).
- Anormalidades en los movimientos de seguimiento ocular. Se ha demostrado que las anormalidades en el seguimiento ocular distinguen a los familiares de esquizofrénicos, incluyendo los gemelos monozigóticos, de los controles sanos (Holzman y Matthysse, 1990; Iacono y cols., 1992; Levy y cols., 1994), así como las anormalidades en los movimientos sacádicos (Keefe y cols., 1997). Se ha sugerido que la disfunción del seguimiento ocular es un indicador conductual sensible de un gen autosómico dominante que aumenta notablemente el riesgo de sufrir esquizofrenia (Matthysse y cols., 1986). El modelo genético sugiere que el 53% de los portadores del gen sufren disfunción en el seguimiento ocular, mientras que en la práctica menos del 10% sufren esquizofrenia. Kinney y cols. (1998) han mostrado que la combinación de disfunción en los movimientos oculares y las complicaciones obstétricas perinatales discriminan significativamente a los pacientes con esquizofrenia de los sujetos sin ella, incluidos los hermanos de los pacientes. Por otra parte la disfunción en los movimientos de seguimiento ocular y las complicaciones obstétricas muestran una correlación inversa en los hermanos sanos de los pacientes esquizofrénicos.
- Dilatación ventricular. Cannon y Marco
(1994) han propuesto las anomalías estructurales del cerebro
como indicadores de vulnerabilidad en la Esquizofrenia. Buchsbaum y
cols. (1997), mediante Resonancia Magnética encuentran que los
pacientes esquizofrénicos tienen un aumento del tamaño
del ventrículo lateral izquierdo a nivel de los cuernos anterior
y temporal, en relación a los controles. Los pacientes con Trastorno
Esquizotípico de la Personalidad muestran una posición
intermedia entre los esquizofrénicos y los controles normales.
Así, la disminución del volumen del hemisferio izquierdo
en las regiones frontal y temporal puede caracterizar tanto los trastornos
psicóticos como no psicóticos del Espectro de la Esquizofrenia.
Utilizando técnicas de Resonancia Magnética y Resonancia Magnética Espectroscópica se ha encontrado que los hijos de pacientes esquizofrénicos tienen un volumen reducido de la amígdala izquierda, aumento del tercer ventrículo y un volumen cerebral global más pequeño (Keshavan y cols., 1997). Estos autores han encontrado también en los hijos de los esquizofrénicos una disminución de la razón N-Acetilaspartato en el córtex prefrontal en comparación con el grupo de controles. Se necesitan estudios de seguimiento de estos sujetos para confirmar el valor predictivo que tienen estas medidas en relación con el desarrollo de Esquizofrenia en los sujetos en riesgo. - Disminución de la actividad de la MAO plaquetaria. Diversos estudios han detectado un aumento de la serotonina en las plaquetas y en la sangre total de los esquizofrénicos (De Lisi y cols., 1981; King y cols., 1985). Se pensó que una disminución de la actividad de la MAO, enzima que cataboliza la Serotonina en 5-HIIA, podría explicar el aumento de serotonina plaquetaria (Wyatt y cols., 1973). Algunos estudios han encontrado una disminución de la actividad MAO plaquetaria en Esquizofrénicos con alucinaciones auditivas (De Lisi, 1981). Wyatt propuso considerar la reducción de la MAO plaquetaria como un marcador genético de vulnerabilidad para la Esquizofrenia.
Cuando los factores de riesgo son externos al sujeto surge el concepto de exposición al factor. Cabe distinguir distintos parámetros de la exposición tales como duración, frecuencia e intensidad. Cuando la exposición al factor de riesgo externo se suma a una susceptibilidad individual se dice que el sujeto está amenazado.
El estudio del riesgo es propio de los métodos de la epidemiología analítica. Los estudios analíticos tratan de responder a la pregunta ¿Por qué? y se ocupan de realizar un razonamiento causal. A diferencia de ellos los estudios observacionales permiten constatar una situación dada, tratan de responder a preguntas generales tales como ¿Cuándo y cómo?
Sirven para describir una enfermedad determinada y para generar hipótesis que conduzcan a estudios analíticos. Su metodología es descriptiva, siendo muy útiles para calcular la prevalencia o la incidencia de una enfermedad, describir las propiedades psicométricas de un test diagnóstico, etc. Sin embargo la correlación estadística entre distintas variables, resultado de los estudios observacionales, no significa una asociación causal. La relación entre un factor y una enfermedad, por mucha significación estadística que tenga, y aunque no pueda ser atribuida al azar, es insuficiente para establecer una relación causal.
El cálculo de los riesgos se realiza mediante estudios prospectivos o retrospectivos. Los Estudios retrospectivos o de Casos-Controles precisan de un número relativamente escaso de sujetos, sin embargo son muy susceptibles a errores de muestreo, ya que los pacientes elegidos pueden no ser representativos de los sujetos con esquizofrenia, y a errores de medición, ya que los datos de interés no han sido recogidos de forma ciega, con criterios operativizados ni por el mismo investigador.
Como ejemplo de un estudio de Casos-Controles en la investigación de Factores de Riesgo en la Esquizofrenia describiremos brevemente el Estudio Familiar de Roscommon, realizado por Kendler y cols. (1993). Tradicionalmente el estudio de la etiología de la Esquizofrenia ha considerado el papel etiológico de los factores familiares. El objetivo del estudio de Kendler y cols. era examinar el grado de agregación familiar de Esquizofrenia y otras psicosis no afectivas en las familias de Esquizofrénicos en una comunidad rural en el Oeste de Irlanda. El Estudio definió dos grupos de Casos: 285 personas con diagnóstico de Esquizofrenia reclutados mediante el Registro de Casos Psiquiátricos del Condado de Roscommon, nacidos a partir de 1930; 99 casos de Trastornos Afectivos severos recogidos del mismo registro y un Grupo control apareado, consistente en una muestra aleatoria de 150 residentes de Roscommon recogidos a partir del registro electoral. Los resultados muestran que los familiares de los esquizofrénicos muestran un riesgo aumentado de sufrir Esquizofrenia (6,5%) frente a los pacientes con Trastornos afectivos psicóticos (2,8%) y los controles (0,5%).
Los Estudios prospectivos o de Cohorte permiten diseñar las mediciones con antelación y eliminar errores de medición. Los resultados sin embargo son difíciles de valorar por la presencia de variables de confusión (García Roldán, 1995). Doreste (1993) distingue tres tipos de Estudios de Cohorte: Estudios de Cohorte Prospectivos, Ambispectivos e Históricos (tabla II).
En los Estudios de Cohorte Prospectivos el planteamiento del estudio precede a la determinación de la presunta causa y a la aparición de los efectos. Como ejemplo de Estudio prospectivo en la investigación de Factores de riesgo en la Esquizofrenia citaremos la investigación realizada por Jones y cols. (1998) con la finalidad de determinar si las complicaciones durante el embarazo, el parto y el período neonatal se asocian con el desarrollo de esquizofrenia en la Edad adulta.

La cohorte se formó en 1966 a partir de la población general Finlandesa reclutando 12.068 mujeres embarazadas de las provincias de Oulu y Lapland cuyo alumbramiento estaba previsto en 1966. De los 12.058 nacidos vivos, los niños en riesgo se siguieron hasta la edad de 27 años. Se recogieron todos los casos detectados a lo largo de ese período en el Registro de Altas de los Hospitales Finlandeses. En los 515 niños de la Cohorte expuesta se dieron 76 casos de Esquizofrenia. Los esquizofrénicos habían estado expuestos con mayor frecuencia a circunstancias adversas: bajo peso al nacer, gestación de menos de 37 semanas, etc. De 125 supervivientes de daño cerebral severo el 4,8% desarrollaron posteriormente esquizofrenia (Odds ratio: 7,5).
En los Estudios Ambispectivos la investigación se inicia con posterioridad al comienzo de acción de la causa de la enfermedad. Los datos sobre dicha exposición están disponibles, pero aún no ha aparecido su efecto. Como ejemplo de Estudio de Cohorte Ambispectivo en la investigación de Factores de riesgo en la esquizofrenia citaremos la investigación realizada por Malmberg y cols. (1998). La investigación estaba planteada con el objetivo de comprobar la asociación de anomalías en el ajuste social y las características premórbidas de la personalidad con el desarrollo ulterior de esquizofrenia y otras psicosis.
Estos autores reclutaron en Suecia, entre 1969 y 1970, una Cohorte de 50.087 varones comprendidos entre los 18 y 20 años a su entrada en el Servicio Militar. Esta muestra representaba a los varones Suecos nacidos entre 1949 y 1950 excepto un 2-3% que fueron exentos por sufrir enfermedades o incapacidades severas. En el momento de entrar en la Cohorte se realizó un estudio psiquiátrico para determinar rasgos de personalidad y patrones de relaciones interpersonales y ajuste social, excluyéndose del estudio 33 casos de psicosis. A lo largo del seguimiento se utilizó el Registro Nacional de Casos Psiquiátricos para identificar los sujetos de la cohorte que precisaron tratamiento por sufrir Esquizofrenia. El período de seguimiento se cerró en 1983, habiéndose recogido 195 casos nuevos de Esquizofrenia hospitalizados al menos en una ocasión y 193 casos de otros tipos de psicosis.
En los Estudios de Cohorte Históricos la identificación de la Cohorte de expuestos y no expuestos se realiza en base a registros de datos preexistentes y a partir de ese momento se investiga la tasa de incidencia de la enfermedad en ambas. El inicio de la investigación es posterior a la aparición de la causa y el efecto. Como ejemplo citaremos el estudio de Van Os y Selten (1998) sobre el efecto de la exposición materna durante el embarazo a circunstancias de estrés bélico sobre el desarrollo ulterior de Esquizofrenia.
Holanda fue ocupada por las tropas Alemanas entre el 10 y el 14 de Mayo de 1940. La ciudad de Rotterdam fue bombardeada, siendo el resultado la destrucción de 24.000 casas. En los combates fallecieron 2.200 soldados y 2.100 civiles. Los autores recogieron los nacidos vivos en Holanda entre 1938 y 1943 a partir del la Oficina Central Holandesa de Estadísticas. Los autores definieron la cohorte de expuestos incluyendo a los sujetos cuyas madres estaban embarazadas en el momento de la invasión (del 10 al 14 de mayo de 1940). La cohorte de no expuestos se formó con sujetos nacidos en los correspondientes períodos en los dos años previos y sucesivos. Las cohortes, formadas por un método histórico, fueron seguidas a través del Registro Nacional de Casos Psiquiátricos durante el período 1970-1994. Los sujetos expuestos mostraron un aumento de riesgo de Esquizofrenia (Riesgo relativo: 1,15), ligero pero estadísticamente significativo.
Existen diversos Indicadores cuantitativos de una asociación causal que vamos a pasar a describir. El Riesgo individual es una expresión probabilística de las posibilidades que tiene un individuo o un grupo de ser afectado por una enfermedad. También se denomina Tasa de ataque y viene dada por la incidencia global para el período y el acontecimiento. El cálculo del riesgo individual se basa en estudios de incidencia o de mortalidad. Así por ejemplo la incidencia de la esquizofrenia se ha calculado en un rango entre 0,43 y 0,69 por mil habitantes al año (Babigian, 1982), y la prevalencia-vida entre un 1 y un 1,5% (Kaplan y cols. 1994).
Sin embargo el Riesgo epidemiológico de sufrir esquizofrenia no es idéntico para todos los individuos que componen una población, por lo que para estimarlo no basta con las cifras de prevalencia o incidencia. Interesa medir Riesgos específicos, es decir la relación entre la frecuencia de la esquizofrenia en una población específica expuesta a un factor y la frecuencia en el resto de la población. Así, aunque la incidencia para una definición rigurosa de caso no varía mucho de unos países a otros, cuando la definición es amplia la incidencia es el doble en los países en desarrollo. Recientemente Cannon y Jones (1996) en un estudio de revisión de los principales artículos sobre el tema han descrito una disminución de un 40-50% en las tasas de primeras admisiones por esquizofrenia en los 70 y 80. También se ha descrito una incidencia de esquizofrenia diez veces más alta en la población Afro-Caribeña de Nottingham que en la población general.
El Riesgo etiológico es una expresión más afinada de una relación causal. Puede medirse a través de tres indicadores distintos: el riesgo relativo, el riesgo atribuible y la fracción etiológica del riesgo (Jenicek y Cléroux, 1987).
El Riesgo Relativo es la relación entre la tasa de enfermedad en los sujetos expuestos al probable factor causal y la tasa en los no expuestos. Dicho de otra manera es el cociente de la incidencia de casos nuevos en el grupo de los expuestos al factor, entre la incidencia observada en los no expuestos. No es un porcentaje sino un múltiplo de la probabilidad de ser afectado. Si no hay asociación entre la esquizofrenia y el factor propuesto el riesgo relativo es 1, ya que la tasa en los expuestos es similar a la tasa en los no expuestos. Cuando el Riesgo relativo es menor de uno entonces el factor es protector.
El Riesgo Atribuible es la parte del riesgo individual que puede ser relacionada exclusivamente al factor estudiado y no a otros. Se obtiene sustrayendo de los expuestos la tasa de aparición de la enfermedad en los no expuestos. La aparición de la enfermedad en los no expuestos ha de deberse a la exposición a otros factores. Se supone que esos otros factores han contribuido, junto con el que se estudia, a la aparición de la enfermedad en el grupo de los expuestos dado que esos factores se distribuyen de la misma forma en ambos grupos. El resultado es una tasa real.
La Fracción etiológica del riesgo es el porcentaje del riesgo que se puede atribuir a la acción del factor estudiado. Puede calcularse para el conjunto de expuestos o para el total de la población estudiada. Es la expresión en forma de proporción del riesgo total en un grupo. Un riesgo relativo alto no conlleva un riesgo atribuible alto. El riesgo relativo es una medida de asociación tendente a establecer hipótesis causales. El riesgo atribuible facilita más bien la toma de decisiones preventivas al indicar los beneficios que se obtendrían al suprimir un factor de riesgo.
En los Estudios retrospectivos no se puede calcular la tasa de ataque o de incidencia de la esquizofrenia en la población expuesta, o sea, el riesgo individual en expuestos y en no expuestos. En una situación como ésta no es posible calcular el riesgo de enfermar bajo la influencia del factor o sin él (Sentís, 1993), y por lo tanto no podremos calcular el Riesgo Relativo. Necesitamos un método distinto para determinar la relación del factor de riesgo con la enfermedad. La mejor estimación del Riesgo Relativo en los Estudios retrospectivos es el cálculo del Odds Ratio de exposición al factor, que es un cociente de probabilidades: la razón de encontrar expuestos al factor entre los casos en relación a la de encontrar expuestos al factor en los controles (Doreste, 1993). Con esta estimación del Riesgo relativo se puede luego calcular el Riesgo Atribuible (Cole y McMahon, 1971) y la Fracción Etiológica del Riesgo (Miettinen, 1976). También podemos calcular la Proporción de exposición en los controles y en los testigos.
Las Estrategias de alto riesgo (tabla III) se han puesto en marcha para investigar las características de la vulnerabilidad a la esquizofrenia. Para ello se han propuesto diversos métodos de reclutamiento de cohortes consideradas de alto riesgo formadas por personas que aún no han alcanzado la edad para el desarrollo de esquizofrenia (Keshavan y Sharma, 1998). Así, entre otras, se han propuesto las siguientes subpoblaciones de alto riesgo:

- Hijos de esquizofrénicos. Se han desarrollado estudios para determinar las variables psicosociales y biológicas presentes antes del inicio de la enfermedad. El reclutamiento de casos es difícil dadas las bajas tasas de reproducción de los pacientes esquizofrénicos.
- Hermanos de esquizofrénicos.
- Los gemelos monozigóticos discordantes para la esquizofrenia.
- Sujetos que presentan varios marcadores bioconductuales. Esto supone la selección de individuos que poseen muchos factores de riesgo, lo que eleva la proporción de falsos negativos.
Se han criticado estos estudios porque los hallazgos registrados en una población de alto riesgo puede que no sean generalizables al resto de los esquizofrénicos. Esta misma dificultad se presenta en los estudios de gemelos a la hora de generalizar los resultados a una población de no gemelos. Por otra parte una gran dificultad para las estrategias de alto riesgo es que la mayor parte de los esquizofrénicos no tienen padres afectados, hermanos o cogemelos enfermos.
FACTORES DE RIESGO GENÉTICO
La identificación fenotípica de la esquizofrenia se ha visto facilitada desde la introducción de criterios diagnósticos internacionalmente aceptados con criterios operativos de inclusión y exclusión que en diversos estudios transculturales han resultado ser suficientemente fiables.

Actualmente en los estudios genéticos sobre la Esquizofrenia se incluyen Trastornos severos que se consideran genéticamente relacionados con la enfermedad nuclear (tabla IV). Por ejemplo los Trastornos Esquizoafectivos se ha demostrado que coagregan con la Esquizofrenia y se suelen incluir junto a la Esquizofrenia nuclear en los modelos restringidos de identificación fenotípica (Maier y cols., 1993; Kendler y cols., 1993). También se ha encontrado que otras Psicosis no Afectivas como los Trastornos Esquizofreniformes, las Psicosis Atípicas y los Trastornos delirantes son más prevalentes en los familiares de Esquizofrénicos (Kendler y cols, 1986, 1993; Gladis y cols., 1994), así como los Trastornos de Personalidad Esquizotípico y Paranoide (Webb y cols., 1993). Estos trastornos se incluyen en estudios en que la identificación fenotípica es más amplia.
La observación popular ha elaborado tradicionalmente la idea de que las enfermedades mentales se dan en familias (Price, 1995; Kendler y Diehl, 1995). Los estudios familiares realizados en la década de los treinta encontraron que es más probable que una persona tenga esquizofrenia si otros familiares la padecen y la probabilidad de sufrirla se correlaciona con la proximidad de la relación (Kaplan y cols. 1994). Aunque la mayoría, más del 80%, de los familiares de primer grado de una persona con esquizofrenia no la sufrirán ellos mismos (Moldin y Gottesman, 1997), hoy en día se considera como factor de riesgo elevado el tener antecedentes familiares de esquizofrenia, siendo aún mayor el riesgo cuando los dos padres la han padecido. Por otra parte se aprecia que los riesgos de la mayoría de los familiares de un esquizofrénico son significativamente mayores que en la población en riesgo (Gottesman, 1991).
Hoy en día se sabe que la heredabilidad de la esquizofrenia es de un 50 a un 90%, lo que significa que la posesión de un genotipo particular puede aumentar considerablemente la probabilidad de sufrir esquizofrenia pero no lo hace inevitable. Así la heredabilidad es un concepto probabilístico, no determinístico (Van Os, 1998).
Los familiares de primer grado de pacientes esquizofrénicos tienen un riesgo de un 3-7% de sufrir esquizofrenia, lo cual es un riesgo 5-10 veces más elevado que el que se encuentra en familiares de los controles (Jones y Cannon, 1998). Los gemelos monozigóticos tienen mayor riesgo que los dicigóticos, y éstos más que los hermanos nacidos de partos no gemelares. Por otra parte cuanto más severa es la esquizofrenia es más probable que los gemelos sean concordantes (Kaplan y cols. 1994). Los padres de un esquizofrénico tienen menos riesgo ya que muchos de ellos han superado el período de riesgo de la enfermedad y por tanto los bajos índices de fertilidad asociados a la misma (tabla V).

No obstante, el hecho de que una enfermedad se dé en familias no implica necesariamente una etiología genética (Weiner, 1982; Jones y Cannon, 1998), ya que en el caso de las alteraciones muy prevalentes en la población general la mayoría de las familias puede tener algún miembro afectado aunque la enfermedad no sea genética.
Por otra parte Kendler (1993) plantea cómo los estudios familiares realizados desde el primer informe de Rudin en 1916 pueden dividirse en dos grupos sobre la base de la metodología utilizada. Casi todos los estudios realizados inicialmente carecían de grupo control, no utilizaban instrumentos de valoración estructurados o criterios diagnósticos operacionalizados y evaluaban personalmente sólo a una minoría de los familiares. Desde 1980, por el contrario, los diferentes estudios familiares utilizan grupos control, evaluaciones personales de los familiares, diagnósticos ciegos y alguna forma de criterios diagnósticos operacionalizados.
Dado que la agregación familiar puede tener causas genéticas y no genéticas se han utilizado diversos métodos para comprobar el componente genético en la agregación familiar de la esquizofrenia. Para ello los estudios de gemelos proporcionan el mejor instrumento si se tiene en cuenta la salvedad de que los gemelos pueden estar expuestos a diferentes factores ambientales.
La alta concordancia encontrada en los gemelos idénticos, que comparten todos los genes, en relación a los gemelos fraternos y otros miembros de la familia, que tienen genes segregados, sugiere que la interacción genética puede ser importante en la esquizofrenia. Se han realizado doce estudios principales de gemelos en la esquizofrenia. Todos muestran que el riesgo de esquizofrenia en el cogemelo de un probando esquizofrénico es mayor para los monozigóticos (53%) que para los dizigóticos (15%) (Kendler y Diehl, 1995).
Se ha sugerido la posibilidad de que las tasas de discordancia en gemelos puedan ser debidas a la aparición de casos esporádicos y fenocopias causadas por anormalidades cerebrales o virus. El estudio de Cannon y cols. (1997) sugiere que el 83% de la varianza de la probabilidad de sufrir esquizofrenia es causada por factores genéticos adicionales y el 17% por factores ambientales. Gottesman y Bertelsen (1989) sugieren que la discordancia en gemelos idénticos puede ser explicada primariamente por una penetrancia incompleta, o sea la capacidad de la vulnerabilidad o genotipo esquizofrénico de no expresarse a no ser que sea liberada por algún tipo de stress ambiental familiar o extrafamiliar. Estos autores muestran cómo los hijos de un cogemelo monozigótico sano, discordante para la esquizofrenia, tienen mayor riesgo de desarrollar esquizofrenia en comparación con la población general, y que este riesgo es comparable al de los hijos del gemelo esquizofrénico. Así, una predisposición a la esquizofrenia puede transmitirse de generación en generación, aunque la enfermedad no se exprese en el padre.
Sin embargo el hecho de que al menos el 50% de los gemelos monozigóticos, a pesar de compartir el 100% de los genes, no padezcan esquizofrenia habla de la importancia de los factores ambientales en el origen de la esquizofrenia.
Los Estudios en personas adoptadas son la mejor forma de separar los efectos genéticos de los ambientales. Los estudios de gemelos monozigóticos adoptados muestran que los gemelos que son criados por padres adoptivos tienen esquizofrenia con la misma prevalencia que sus hermanos gemelos criados por sus padres biológicos. Este hallazgo sugiere que la influencia genética sobrepasa la influencia ambiental. Sin embargo también se ha observado que los gemelos monozigóticos adoptados tenían más probabilidad de haber sido adoptados por familia psicológicamente perturbadas (Kaplan, Sadock y Grebb, 1994).
Es necesario por otra parte determinar si la forma de herencia es unigénica, a través de unos pocos genes, o poligénica, si es dominante o recesiva. Las Leyes de Mendel se mantienen para las formas más raras de patología humana como la fenilcetonuria, la fibrosis quística, la neuro-fibromatosis y la distrofia muscular de Duchenne. Para las enfermedades frecuentes, entre ellas las psiquiátricas, la forma constante es la herencia multigénica (Price, 1995).
Los datos conocidos sobre la genética de la esquizofrenia no siguen un modelo recesivo o dominante simple: si fuera un mecanismo recesivo simple la frecuencia en los hijos de dos padres esquizofrénicos sería del 100%, pero realmente está por debajo del 40%. Si fuera una herencia dominante simple estaría afectado el 50% de los hijos de un padre esquizofrénico, cuando en realidad la proporción oscila entre el 8 y el 12%. En este caso todo el mundo que sufre esquizofrenia habría de tener un padre enfermo, mientras que realmente en muchos casos los dos padres están sanos (Mowry y cols., 1997). Por otra parte la prevalencia en los hijos es demasiado baja para ser consistente con la elevada tasa de concordancia en gemelos monozigóticos (50%).
Así, el efecto genético no es completamente penetrante, lo que indica que muchos familiares de esquizofrénicos portan una susceptibilidad genética silente. Resulta desconcertante, por otro lado, que se mantenga la prevalencia de esquizofrenia a pesar de la baja tasa de fecundidad de los esquizofrénicos. Los mecanismos exactos de la herencia siguen siendo desconocidos aunque la hipótesis más aceptada es que la mayor parte de casos resultan de mecanismos oligogénicos o poligénicos (Mowry y cols., 1997).
El descenso exponencial en las tasas de concordancia de los gemelos monozigóticos (50%) a los hermanos (10%) indica que la esquizofrenia puede ser debida a los efectos de múltiples genes, que contribuyen cada uno a la probabilidad de desarrollar esquizofrenia, más que el efecto de un solo gen, como es el caso de la Distrofia Muscular de Duchenne o la Corea de Huntington. Parece que estamos ante una genética de múltiples genes con escaso efecto que actúan de una forma probabilística, y muchos de estos genes parece que actúan mediante un aumento de sensibilidad a ciertos factores ambientales (Van Os, 1998).
Por otra parte la heterogeneidad genética está por explorar suficientemente. Hoy en día sabemos que la esquizofrenia se agrega en familias sin que aún se conozcan subtipos familiares (Kendler y cols., 1994).
Por lo que se refiere a los mecanismos de la trasmisión genética, en la actualidad la información proviene tanto de la epidemiología genética como de la genética molecular. El desarrollo y rápida progresión de la genética molecular ha proporcionado una amplia variedad de métodos para buscar genes de predisposición para las enfermedades humanas. Varias regiones del genoma se han propuesto como locus de genes de susceptibilidad para la Esquizofrenia.
La identificación de pedigrees amplios de personas afectadas permite la investigación de las familias a la búsqueda de polimorfismos de longitud de los fragmentos de restricción que se segregan con el fenotipo de la enfermedad. Más de la mitad de los cromosomas se han asociado con la esquizofrenia en diversos informes, pero los brazos largos de los cromosomas 5, 11 y 18, así como el brazo corto del cromosoma 19 y el X han sido los más regularmente informados (Kaplan, Sadock y Grebb, 1994).
Los avances en la genética molecular han descubierto nuevas asociaciones en los cromosomas 6, 8 y 22 y han sugerido modelos complejos, incluyendo la anticipación para explicar la perpetuación de la transmisión genética ante la escasa fecundidad de los esquizofrénicos (Cannon y Jones, 1998).
La anticipación supone una disminución en la edad de inicio y/o un aumento de la severidad de una enfermedad en sucesivas generaciones. Tanto la anticipación como el imprinting, diferentes modos de transmisión parental, se han sugerido en enfermedades por amplificación repetida de trinucleótidos. Ohara y cols. (1997) han tratado de verificar estas hipótesis en la Esquizofrenia familiar estudiando dos generaciones de 49 esquizofrénicos pertenecientes a 24 familias. La edad de inicio se encontró significativamente más baja en la generación de hijos, aunque no se encontró diferencia en la severidad de la enfermedad entre ambas generaciones. Las puntuaciones de síntomas negativos y de curso clínico en la segunda generación fueron significativamente más elevados en la transmisión paterna que en la materna. Sobre esta base los autores sugieren la existencia de imprinting y anticipación en la esquizofrenia.
Sin embargo, aunque las enfermedades por expansión de trinucleótidos repetidos se caracterizan por la anticipación, Ohara y cols. (1997) no han podido encontrar la exclusión de cinco expansiones de trinucleótidos repetidas en 17 familias con esquizofrenia.
Las pruebas para las regiones en 6p y 8p, confirmadas en diversos estudios internacionales colaborativos que generalmente se replican mutuamente, dan apoyo a la idea de genes de susceptibilidad (Gottesman y Moldin, 1997), aunque las asociaciones aún no se han confirmado (Moldin y Gottesman, 1997). Las pruebas existentes para las regiones en 3p, 5q, 9p, 20p y 22q son menos convincentes (Gottesman y Moldin, 1997). Mowry y cols. (1997) en una revisión de los hallazgos sobre los cromosomas 3, 6, 8, 13, 18 y 22, y del X, encuentran apoyo para la tesis de la existencia de tres lugares de susceptibilidad (6p24-22, 8p22-21 y 22q12-q13.1). Sin embargo en la actualidad el número de locus de susceptibilidad, el riesgo de enfermedad que confiere cada locus y el grado de interacción entre los mismos siguen siendo desconocidos (Moldin y Gottesman, 1997).
En los pacientes con esquizofrenia de inicio adulto, y en psicosis no especificadas, se ha observado un aparente exceso de aneuploidías en los cromosomas sexuales: XXY, XXX y posiblemente XYY. Kumra y cols. (1998) han validado este hallazgo en casos de Esquizofrenia de inicio infantil. Los autores realizaron un screening citogenético en 66 pacientes con psicosis infantiles. Encontraron anomalías en los cromosomas sexuales en un 6,1% (mosaico 47, XXY; 47, XXY; 47, XYY; y mosaico 45, XO), tasa más elevada que la esperada en los niños (1/426) o en la población general (2,34/1.000). Estos hallazgos apoyan la hipótesis de que una pérdida del equilibrio de los productos génicos en los cromosomas sexuales puede predisponer a los individuos afectados a una susceptibilidad a agresiones adicionales genéticas o ambientales, que desembocan en Trastornos psicóticos de inicio en la infancia.
Lindholm y cols. (1998) han investigado si las mutaciones mitocondriales subyacen a la sensibilidad a la esquizofrenia secuenciando el DNAmt de dos pacientes Suecos esquizofrénicos con una actividad baja citocromo-oxidasa, no relacionados, y dos hermanas Escocesas pertenecientes a una familia sospechosa de sufrir una transmisión materna de la enfermedad. Encontraron cinco sustituciones en regiones codificantes que no habían sido previamente descritas como polimorfismos. Estas nuevas sustituciones se estudiaron en 81 pacientes esquizofrénicos y en cinco grupos controles de Suecia y Escocia, encontrándose una frecuencia diferente entre poblaciones. Los resultados no apoyan la asociación de una sustitución particular de DNAmt con un riesgo aumentado para la esquizofrenia.
El gen de la metilentetrahidrofolato reductasa (MTHFR) posee polimorfismo en la población general. En su forma homozigótica ocurre una mutación C677T en más del 5% de la población adulta y produce una variante termolábil que reduce la actividad global de la enzima a menos del 30% de lo normal. Regland y cols. (1997) investigaron pacientes con psicosis esquizofrénicas determinando el genotipo DNA para la mutación C677T si resultaban ser hiperhomocistinémicos. Siete de once pacientes fueron homocigotos para la MTHFR termolábil. Un paciente varón fue heterozigoto y los tres homozigotos normales fueron mujeres. En los pacientes homozigotos para la mutación C677T las concentraciones de homocisteína no respondieron a la vitamina B12 pero se normalizaron con suplementos de folato. En los homozigotos normales, sin embargo las concentraciones de homocisteína se redujeron utilizando sólo Vitamina B12. Los resultados sugieren que la Homozigosidad para la MTHFR termolábil es un factor de riesgo para la Esquizofrenia.
FACTORES DE RIESGO AMBIENTALES
Los modelos aditivos simples sugieren que al menos el 20-30% de la varianza en la probabilidad de padecer esquizofrenia se puede atribuir a factores no genéticos (Jones y Cannon, 1998). Diversos factores ambientales se han señalado como importantes variables para el desarrollo de esquizofrenia: estresores inespecíficos, complicaciones obstétricas, abuso ilícito de drogas, etc., sin embargo el valor predictivo que poseen es bajo (Moldin y Gottesman, 1997). En epidemiología se considera que las asociaciones verdaderamente causales tales como fumar tabaco y cáncer de pulmón, superan los riesgos relativos de 10 o más (Jones y Cannon, 1998).
En la actualidad se plantea que los factores de riesgo no genéticos en la esquizofrenia son efectos ambientales no compartidos, es decir, acontecimientos ambientales altamente idiosincráticos, con independencia de la sistematización que caracterice la exposición a los mismos (tabla VI). Los datos de McGuffin y cols., (1994) apuntan a esta conclusión: encuentran en diversos estudios de gemelos una heredabilidad del 89% sin contribución del ambiente compartido. También los resultados de McGue y cols. (1983), que llegan a una heredabilidad del 74%, dan muy poco papel a acontecimientos ambientales compartidos.
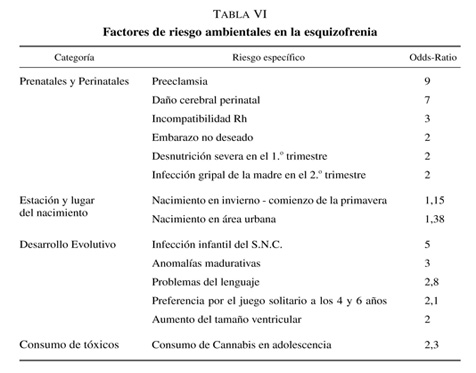
Factores de riesgo durante el embarazo y el parto
El peso de estos factores en el riesgo es generalmente bajo lo que indica que es difícil que sean agentes causantes únicos. Las complicaciones del embarazo se han asociado con la esquizofrenia, especialmente la infección gripal de la madre durante el segundo trimestre del embarazo (Mednick y cols. 1988, O’Callaghan y cols., 1991; Sham y cols., 1992), aunque también la desnutrición durante el primer trimestre (Susser y Lin, 1992; Susser y cols., 1996), el peso bajo de la madre (Crow y Done, 1992) y la incompatibilidad Rh (Hollister y cols., 1996).
Glover (1997) ha puesto de manifiesto que la ansiedad y el estrés materno durante el embarazo tiene efectos a largo plazo sobre el desarrollo emocional del niño. Así, se ha subrayado el efecto de la exposición de la embarazada durante el segundo o tercer trimestre del embarazo a la pérdida de su marido (Huttunen y Niskanen, 1978), de la exposición a hambrunas durante el primer trimestre (Susser y cols., 1995) y del embarazo no deseado (Myhrman y cols. 1996). Meijer (1985) presentó datos sugestivos de que los hijos de madres que fueron expuestas a la amenaza de la guerra Árabe-Israelí de los seis días mostraron retrasos evolutivos y comportamiento desviado.
Recientemente Van Os y Selten (1998) han puesto en relación el estrés materno prenatal con el desarrollo ulterior de esquizofrenia estudiando el riesgo en una cohorte expuesta en Mayo de 1940 a los cinco días de invasión de Holanda por el ejército alemán. El riesgo acumulativo de esquizofrenia fue más alto en la cohorte expuesta, siendo el riesgo relativo de 1,15 para el conjunto, y más elevado para los expuestos en el primer trimestre del embarazo (Riesgo relativo: 1,28).
El efecto del estrés se ha puesto en relación con una incapacidad de los enzimas placentarios para neutralizar los efectos neurotóxicos e inhibidores del crecimiento que poseen los glucocorticoides en el caso del estrés materno. También se ha relacionado el estrés con la producción de cortisol por el propio feto en respuesta a la vasoconstricción uterina e hipoxia fetal inducidas por elevados niveles de catecolaminas maternas.
Las personas con esquizofrenia experimentan de forma significativa más complicaciones durante el parto y el alumbramiento que la población general (Lewis y cols., 1989; Geddes y Lawrie, 1995). Se ha sugerido que la patogenia de las complicaciones obstétricas sería la hipoxia fetal a la que es sometido el feto, bien por hemolisis, como en el caso de la incompatibilidad Rh, o bien por las complicaciones mecánicas del parto. Dicha hipoxia produciría una lesión en algún sistema neuronal. En otras ocasiones se ha sugerido que sería necesaria una predisposición genética.
El estudio de Jones y cols. (1998) siguiendo durante 28 años a una cohorte reclutada a partir de la población general Finlandesa muestra cómo los niños que sufrieron daño cerebral perinatal tuvieron siete veces más probabilidades de desarrollar esquizofrenia en su vida adulta que el resto de la cohorte. De los 125 supervivientes de un daño cerebral perinatal severo un 4,8% desarrollaron ulteriormente esquizofrenia. La cohorte fue recogida, sin criterios de selección, a partir de una muestra de población general y estaba compuesta de 12.068 mujeres embarazadas cuyo alumbramiento estaba previsto a lo largo de 1966.
Se ha observado que los esquizofrénicos es más probable que sufran de bajo peso al nacer y que tengan un perímetro cefálico menor. Se han señalado también anormalidades físicas menores y dermatoglíficas (McGrath y Murray, 1995). De nuevo, el valor predictivo de las complicaciones del embarazo y el parto es bajo dado su elevada frecuencia en la población general, donde raramente se asocian con esquizofrenia.
Lugar y fecha de nacimiento
Se ha asociado un aumento del riesgo a los nacimientos que se producen en áreas urbanas (Lewis y cols., 1992). En realidad los procesos de urbanización habrían de considerarse como indicadores de una multitud de otros factores de riesgo posibles. Se ha encontrado un riesgo aumentado de sufrir esquizofrenia entre los sujetos nacidos en invierno y comienzo de la primavera (Bradbury y Miller, 1985). El mecanismo de aumento del riesgo se atribuye a las mayores probabilidades de sufrir una infección viral en esa época del año.
Alteraciones del neurodesarrollo como factores de riesgo
Los estudios de seguimiento realizados con hijos nacidos de madres esquizofrénicas muestran que entre el 25 y el 50% presentan alteraciones del neurodesarrollo (Fish, 1992; Marcus y cols., 1993), entre las que se incluyen:
-
Hipoactividad, hipotonía, dificultad para recibir caricias y abrazos en el período neonatal.
-
Signos neurológicos menores, sobre todo pobre coordinación motora en la infancia temprana.
-
Déficits de atención y procesamiento de la información en la infancia tardía.
En el estudio de seguimiento iniciado en Inglaterra en 1946 de 4.746 niños de la población general (Jones y cols., 1994), así como en el National Child Development Study (Done y cols., 1994; Crow y cols., 1995) se ha observado que los niños que ulteriormente desarrollaron esquizofrenia podían ya distinguirse durante la infancia del resto de la cohorte en diversos parámetros:
- Retraso motor en general y en la capacidad de andar (Media de 1,2 meses).
- Más problemas del lenguaje.
- Peor rendimiento educativo a los 8, 11 y 15 años.
- Preferencia por juegos solitarios a los 4 y 6 años.
- Pobre ajuste social en la infancia.
Fish y cols. (1987 y 1992) estudiaron 24 niños de contextos desfavorecidos, doce de ellos hijos de madres con esquizofrenia crónica. Estos niños fueron estudiados nuevamente 7-8 años más tarde. Siete de los doce hijos de madres esquizofrénicas, y sólo uno del grupo control sufrían un trastorno neurointegrativo que denominó Pandismaduración y que definió como una laguna transitoria en la organización del desarrollo motor grosero y/o del desarrollo visomotor.
Walker y Lewine (1990) analizaron vídeos caseros realizados en contextos familiares ecológicamente válidos de niños que llegaron a desarrollar esquizofrenia, así como otros vídeos similares de sus hermanos sanos. Emitiendo un juicio clínico ciego, diversos profesionales pudieron identificar a los niños que más tarde desarrollaron esquizofrenia. Walker y cols. (1993) observando vídeos de 32 pacientes esquizofrénicos con 31 hermanos sanos encontraron que las niñas que desarrollaron esquizofrenia mostraban significativamente menos expresiones faciales de alegría, aunque este hallazgo no se pudo generalizar a los niños. En otro trabajo Walker y cols. (1994) encontraron a través del análisis de vídeos infantiles que los niños que desarrollaron ulteriormente esquizofrenia presentaban signos neurológicos menores.
Sin embargo aún con predictores como la Pandismaduración, que tienen una especificidad del 95% y una sensibilidad del 90%, la probabilidad de predecir correctamente qué niños serán esquizofrénicos es muy baja. Hasta 85% de los niños que muestran los signos predictivos no desarrollarán esquizofrenia (Kagan y Zentner, 1996).
Factores interpersonales
Algunos autores han propuesto como factores de riesgo para la esquizofrenia la existencia de problemas interpersonales y la dificultad para establecer relaciones fuera de la familia a lo largo de la infancia, la adolescencia y el comienzo de la juventud (Robins, 1966; Lewine y cols., 1980; Isele y cols., 1985). Los hallazgos de Watt (1972) sugieren que el trastorno aumenta con la edad, y que el inicio y establecimiento de relaciones sexuales representa un problema muy particular. Malmberg y cols. (1998) en su estudio encuentran la mayor asociación con la incapacidad de tener una novia estable.
Cornblatt propone buscar signos prodrómicos a los 17 años en hijos de alto riesgo como predictores de la enfermedad ulterior. En el estudio llevado a cabo dentro del proyecto de alto Riesgo de Nueva York encuentra que los hijos de esquizofrénicos muestran déficits neurocognitivos de la atención, de los movimientos oculares, y de la memoria de trabajo ya a los 10 años, así como rasgos esquizotípicos de la personalidad. Tras diez años de seguimiento los déficits cognitivos empeoraron en aquellos que desarrollaron ulteriormente esquizofrenia. Por otra parte los rasgos de personalidad esquizotípicos se normalizaron parcialmente en aquellos que no desarrollaron la enfermedad hacia la mitad o el final de la adolescencia, a diferencia de los que la padecieron, que mostraron un deterioro gradual y nunca llegaron a recuperarse (Nidecker, 1999).
Malmberg y cols. (1998) en el curso de un estudio de seguimiento durante 15 años de 50.087 jóvenes reclutados a los 18 años en el servicio militar han encontrado cuatro variables que reflejan problemas en las relaciones interpersonales independientemente asociadas con el desarrollo ulterior de esquizofrenia. Los autores concluyen que algunos aspectos de la personalidad y el ajuste premórbido pueden actuar como factores de riesgo para la esquizofrenia.
Anomalías cerebrales
También se ha descrito que los pacientes esquizofrénicos tienen ventrículos laterales más amplios que los controles. Weinberger y cols. (1981) encontraron que tanto los esquizofrénicos como sus hermanos sanos tienen ventrículos cerebrales significativamente más amplios que los controles. Reveley y cols. (1982) encontraron un patrón similar de resultados en un estudio de gemelos monozigóticos discordantes para la esquizofrenia. El nivel de riesgo asociado con el aumento de tamaño ventricular, ajustado para el volumen intracraneal, edad, sexo, raza y clase social es aproximadamente de dos (Jones y cols., 1994).
Como parte del proyecto de Alto Riesgo de Copenhague, iniciado en 1962 por Mednick y Schulsinger, Cannon y cols. (1993) realizaron entre 1980 y 1983 una valoración estructural de la patología cerebral en los probandos hijos de madres esquizofrénicas y en los controles de la cohorte. Los resultados muestran que el aumento del tamaño ventricular se relaciona linealmente con el riesgo genético y que el efecto de las complicaciones en el parto sobre el aumento del tamaño ventricular fue mayor cuanto mayor era el riesgo genético de los probandos. Los autores concluyen planteando que la agregación familiar significativa de anormalidades cerebrales en esquizofrénicos refleja un modo genético de transmisión ya que existe una relación lineal con el número de familiares afectados y el riesgo es estadísticamente independiente de las complicaciones perinatales y otras fuentes ambientales de daño cerebral.
Habiéndose observado un exceso de anomalías de lateralización en la Esquizofrenia Cannon y cols., estudiaron la preferencia manual y la dominancia visual como factores de riesgo para la esquizofrenia adulta en una cohorte de la población general recogida al nacimiento. Los niños preesquizofrénicos mostraron un exceso significativo de dominancia visual izquierda sin que se demostraran diferencias significativas en la dominancia manual entre niños preesquizofrénicos y controles.
Epilepsia y Esquizofrenia
Los pacientes con epilepsia desarrollan psicosis o Esquizofrenia en una tasa que excede la esperada si los dos trastornos fueran independientes. De forma similar los pacientes con Esquizofrenia son más proclives a sufrir convulsiones que la población general (Hyde y Weinberger, 1997). Estos autores señalan que este exceso de vulnerabilidad puede ser conferido por el sustrato neuropatológico de la Esquizofrenia o como efecto secundario de la enfermedad, incluyendo la exposición a medicaciones psicotrópicas que disminuyen el umbral convulsivo.
Se ha encontrado que la epilepsia aumenta el riesgo de desarrollar Esquizofrenia y otras psicosis funcionales no afectivas. En Dinamarca Bredkjaer y cols. (1998) a partir de una muestra de 67.116 personas con epilepsia recopiladas del Registro Nacional de Pacientes, identificaron las personas con psicosis no afectivas a partir del Registro de Casos Psiquiátricos Danés. Los resultados muestran un aumento significativo de esquizofrenia para ambos sexos en las personas con epilepsia.
Las investigaciones neuropatológicas del sustrato anatómico de las convulsiones en pacientes con Psicosis o Esquizofrenia son consistentes con la noción de que existen anomalías en el neurodesarrollo que comprometen el lóbulo temporal medial (Hyde y Weinberger, 1997).
El cociente intelectual como factor de riesgo
David y cols. (1997) subrayan la importancia de la capacidad intelectual baja como factor de riesgo para la esquizofrenia y otras psicosis. Estos autores han encontrado una relación lineal entre el cociente intelectual bajo y el riesgo de sufrir esquizofrenia en un estudio de seguimiento de 50.000 soldados del ejército Sueco reclutados entre 1969 y 1970, que fueron seguidos mediante el Registro de Casos Psiquiátricos Sueco. También se encontró un riesgo elevado en los sujetos con Cociente intelectual bajo en relación al padecimiento de trastornos no esquizofrénicos, aunque el efecto fue menos marcado y no lineal. Los autores descartan que el riesgo sea debido a un deterioro prodrómico. La asociación podría ser directamente causal con el deterioro cognitivo, lo que conduciría a falsas creencias y percepciones, o podría ser indirecta con factores que afecten la capacidad intelectual tales como desarrollo cerebral anormal.
Consumo de Cannabis
El estudio de Andreasson y cols. (1987) en Suecia ha mostrado cómo el consumo intenso de Cannabis a la edad de 18 años se asocia con aumento del riesgo de sufrir posteriormente una psicosis.
Efecto de la crianza por madres esquizofrénicas
Higgins y cols. (1997) desarrollaron un estudio de 25 años de seguimiento de 50 hijos de madres esquizofrénicas, de los cuales 25 fueron criados por sus madres y 25 criados aparte. Se realizó una valoración psiquiátrica a la edad adulta mediante una entrevista psiquiátrica estructurada de 3 horas y una batería de escalas. Entre los sujetos criados aparte se encontró una incidencia ligeramente más alta de psicopatología, incluyendo Trastornos del espectro de la Esquizofrenia. Los autores atribuyen esto a su mayor predisposición genética, dado que sus madres sufrían enfermedades más graves. La prevalencia-vida de los sujetos estudiados no aporta pruebas de que la psicopatología en los hijos en riesgo genético aumente por el hecho de ser criados por su madre esquizofrénica.
MODELOS DE INTERACCIÓN GENES-AMBIENTE
Modelo aditivo
En el modelo aditivo los factores de riesgo genéticos y ambientales operan independientemente, de forma que el riesgo asociado a la exposición a un factor ambiental es similar en personas con genotipo de bajo riesgo que en personas con genotipo de riesgo elevado.
Modelo Interacción Genotipo-Ambiente
Según este modelo los genes controlan el grado de sensibilidad a los factores ambientales, influyendo los factores genotípicos en el nivel de sensibilidad al ambiente (Moldin y Gottesman, 1997; Van Os, 1998). Según este concepto no sólo el mayor o menor grado de exposición a los factores ambientales aumenta de forma correlativa el riesgo de sufrir la enfermedad, sino que hay genotipos más susceptibles que otros. Así, algunos sujetos expuestos al consumo de cannabis tienen un riesgo muy bajo de desarrollar esquizofrenia, mientras otros individuos, con un genotipo diferente, tienen un riesgo muy alto de desarrollar la enfermedad como resultado de esta exposición.
Tienari (1991), en el Estudio Finlandés sobre Familias Adoptivas informa resultados que sugieren la interacción genes-ambiente, controlando los genes la sensibilidad al ambiente. La comunicación alterada en padres adoptivos en conjunción con riesgo genético alto se asoció con riesgo aumentado de esquizofrenia. Por otra parte los hijos de mujeres esquizofrénicas tienen un riesgo menor de desarrollar esquizofrenia cuando son adoptados en un ambiente no disfuncional.
Los padres de los pacientes esquizofrénicos blancos y Africano-Caribeños en el Reino Unido tienen riesgos similares de sufrir esquizofrenia, más elevados que la población control. Sin embargo, los hermanos de la segunda generación de inmigrantes, nacidos en Inglaterra y que poseen factores de riesgo ambientales más numerosos, tienen un riesgo mayor que cualquier otro grupo de familiares y siete veces mayor que el de los controles de raza blanca (Sugarman y Craufurd, 1994; Hutchinson, 1996).
También en el estudio de alto riesgo de Copenhague (Cannon y cols., 1993) se encontró que entre los hijos de madres esquizofrénicas aquellos que desarrollaron ulteriormente esquizofrenia presentaban mayor historia de complicaciones obstétricas durante el parto que los que sólo desarrollaron un trastorno esquizotípico de la personalidad o no desarrollaron la enfermedad. Por otra parte las complicaciones obstétricas sobre el aumento del tamaño de los ventrículos cerebrales aumentó más en los genotipos de alto riesgo. Los hermanos de los pacientes esquizofrénicos, que también están en riesgo no presentan sin embargo tasas más elevadas de complicaciones obstétricas que la población general, descartando así un efecto de correlación gen-ambiente (Cannon y cols., 1997).
Correlación Genotipo-Ambiente
En este modelo se supone que ciertos factores genéticos influyen en la exposición de un individuo a factores de riesgo ambientales.
Se ha observado, por ejemplo, una influencia genética sobre diversos factores ambientales para la enfermedad, tanto acontecimientos vitales (Saudino y cols., 1997), como sobre las complicaciones obstétricas (Van Os, 1998) y la exposición al cannabis (Lyons y cols., 1997).
Se ha encontrado que las complicaciones obstétricas ocurren con mayor frecuencia en pacientes con Esquizofrenia, que en los controles sanos, incluidos los hermanos de pacientes con esquizofrenia y los cogemelos monozigóticos (Parnas y cols., 1982; Kinney y cols., 1994). Una explicación para este hallazgo es que los genes que contribuyen al fenotipo esquizofrénico también aumentan la probabilidad de sufrir complicaciones obstétricas. Si esto fuera verdad el riesgo mórbido de sufrir una enfermedad psiquiátrica habría de ser mayor en los familiares de primer grado de los probandos expuestos a complicaciones obstétricas, tanto si son esquizofrénicos como si son normales, en comparación con los probandos que no han sufrido complicaciones obstétricas.
Para comprobar esta hipótesis Marcelis y cols. (1998) recogieron mediante entrevistas con las madres de 151 pacientes psicóticos y de 100 controles información retrospectiva y con un método ciego sobre la historia familiar de trastornos psiquiátricos. Se recogió la historia familiar en 600 familiares de los casos y en 461 de los controles mediante el FH-RDC y entrevistas personales. En los casos de esquizofrenia el riesgo familiar de sufrir un Trastorno afectivo fue mayor en aquellos que poseían una historia de complicaciones obstétricas (Razón de azar = 1,9), siendo la relación especialmente intensa con la pre-eclampsia (RA = 2,9) y la presentación de nalgas (RA = 2,8). En los controles los Trastornos afectivos de la madre se asociaron con presentación de nalgas (RA = 7,0) y pre-eclamsia (RA = 4,0).
Las complicaciones obstétricas no se relacionaron con el riesgo de sufrir esquizofrenia o psicosis relacionadas. La asociación positiva de las complicaciones obstétricas y el riesgo familiar de Trastorno Afectivo sugiere que los factores que contribuyen a la agregación familiar de síntomas afectivos en pacientes psicóticos también influyen la probabilidad de experimentar Complicaciones obstétricas. Los autores sugieren que parte de la relación entre la historia familiar de Trastornos Afectivos y Psicosis puede ser mediada a través de las Complicaciones Obstétricas, a pesar de que la proporción de las mismas que puede ser atribuida a estos factores es muy pequeña.
En las interacciones genotipo ambiente, tanto de tipo interacción como de correlación, hay una causalidad conjunta, pero la intervención a nivel ambiental puede neutralizar el efecto de los genes. Las intervenciones preventivas diseñadas desde la Epidemiología se dirigen a poblaciones, no a individuos, y han de centrarse en factores de riesgo altamente prevalentes. Se ha demostrado que si pudieran eliminarse los factores de riesgo ambientales en relación con la vida urbana y la pertenencia a ciertas categorías étnicas, la incidencia de esquizofrenia se reduciría en un 30-40% (Van Os, 1998).
ESTADOS DE RIESGO Y PREVENCIÓN
Las intervenciones sobre la población general son difíciles. Últimamente ha despertado mucho interés en los investigadores la elucidación de individuos en riesgo. Los estudios de los familiares de los probandos esquizofrénicos han identificado que ciertas anomalías psicológicas y neurológicas se dan bajo la forma de un espectro. Estas anomalías pueden considerarse como marcadores de vulnerabilidad de la esquizofrenia o como expresiones parciales del trastorno.
Sin embargo los factores de riesgo aceptados señalan sólo un bajo grado de riesgo, y muchos de ellos están muy repartidos en la población general (separación familiar temprana, institucionalización, problemas neurológicos, complicaciones obstétricas, edad entre 16 y 25 años, etc.) mientras que la esquizofrenia no es frecuente. El valor predictivo de los factores de riesgo es muy bajo, por lo que necesitaríamos identificar factores de riesgo que no fueran comunes en la población general, tales como una historia familiar de esquizofrenia o trastornos relacionados. Esto hace que se primen en la actualidad las intervenciones preventivas dirigidas hacia los individuos así como el consejo genético ambiental.
En la actualidad no conocemos signos y síntomas que predigan de manera fiable el inicio de la esquizofrenia y que orienten la puesta en marcha de programas preventivos (Eaton y cols., 1995). Sería muy útil disponer de un signo sensible y específico que pudiera predecir el desarrollo subsecuente de una psicosis con un alto grado de probabilidad y que justificara iniciar un tratamiento antipsicótico (tabla VII).

Keith y Matthews (1991) han señalado la existencia de signos y síntomas prodrómicos de baja intensidad en la fase prodrómica del primer episodio de esquizofrenia. La fase prodrómica, como señalan Yung y cols. (1996), es un concepto retrospectivo por lo que es necesario conceptualizar de otra manera el estado mental de quien exhibe conductas sugerentes de la eclosión inminente de esquizofrenia. Otros autores han propuesto el término «Signos y síntomas precursores» (Eaton y cols. 1995), o el de «Estados mentales de riesgo» (McGorry y Singh, 1995), que no implican que el cuadro clínico será invariablemente seguido por un episodio de esquizofrenia. El concepto de «Estado mental de riesgo» subraya que el síndrome representa un factor de riesgo para la esquizofrenia, es decir, que cuando un sujeto experimental dicho estado está en un riesgo incrementado de que se inicie el trastorno. Si se considera que el «Estado mental de riesgo» forma parte de la enfermedad, entonces la intervención tendría el carácter de prevención secundaria. Sin embargo, si dicho estado se considera como un síndrome separado que confiere un riesgo más elevado para el sujeto, pero no la inevitabilidad de sufrir una psicosis, entonces la intervención habría de considerarse como prevención primaria.
Este concepto se diferencia de otros, como el de rasgos que son Factores de riesgo (trait risk factors), como la historia familiar o ciertos marcadores biológicos. Estos últimos confieren una probabilidad aumentada de sufrir el trastorno en cualquier momento, con independencia del estado mental actual del sujeto (Yung y cols., 1996). En este sentido la hipertensión arterial y otros factores de riesgo coronarios son rasgos que aumentan la probabilidad de sufrir un infarto de miocardio, y la angina de pecho es un estado de riesgo que cuando aumenta su intensidad y frecuencia se denomina síndrome preinfarto, indicando un inminente riesgo de infarto de miocardio. Los dos síndromes tienen la misma enfermedad cardíaca y aterosclerótica subyacente, pudiendo considerarse el primero como una versión atenuada del infarto de miocardio. De la misma manera Yung y cols. (1996), consideran que las ideas sobrevaloradas, los trastornos perceptivos vagos o el humor delirante pueden considerarse como formas atenuadas de los síntomas psicóticos que indican un riesgo aumentado de psicosis. Estos autores consideran que son fenómenos nuevos que han de diferenciarse del Trastorno de Personalidad Esquizotípico previo, un rasgo considerado como factor de riesgo.
Los episodios psicóticos breves que se resuelven espontáneamente pueden indicar aumento de riesgo de sufrir una psicosis. Se han descrito en pacientes que más tarde presentarán trastornos psicóticos (Faergman, 1963; Jauch y Carpenter, 1988), y en trastornos límites de la personalidad (Gunderson y Singer, 1975). En ocasiones son desencadenados por el abuso de drogas aunque también se han descrito en personas aparentemente normales sometidas a experiencias de deprivación sensorial. Ésta es un área de investigación que merece los más denodados esfuerzos por las implicaciones terapéuticas que reviste el encontrar signos predictores del desarrollo ulterior de una psicosis.
REFERENCIAS BIBLIOGRÁFICAS
Andreasson S, Allebeck P, Engström A. y cols. Cannabis and schizophrenia. Lancet 1987; 2: 1483-1486.
Babigian H. Esquizofrenia: epidemiología. En: AM Freedman, HI Kaplan y BJ Sadock: Tratado de Psiquiatría. Barcelona, Salvat 1982; 1: 962.
Bradbury TN, Miller GA. Season of birth in schizophrenia: A review of the evidence, methodology and etiology. Psychol Bull 1985; 98: 569-594.
Bowers MB, Freedman DX. Psychedelic experiences in acute psychoses. Archives of General Psychiatry 1966; 15: 240-248.
Bredkjaer SR, Mortensen PB, Parnas J. Epilepsy and non-organic non-affective psychosis. National epidemiologic study. Br J Psychiatry 1998; 172: 235-238.
Buchsbaum MS, Yang S, Hazlett E, y cols. Ventricular volume and assymmetry in Schizotypal personality disorder and Schizophrenia assessed with magnetic resonance imaging. Schizophr Res 1997; 27 (1): 45-53.
Cameron DE. Early Schizophrenia. American Journal of Psychiatry 1938; 95: 567-578.
Cannon TD, Mednick SA, Parnas J, Schulsinger F. y cols. Developmental brain abnormalities in the offspring of schizophrenic mothers. I. Contributions of Genetic and Perinal factors. Arch Gen Psychiatry 1993; 50: 551-564.
Cannon TD, Marco E. Structrual brain abnormalities as indicators of vulnerability to schizophrenia. Schizophr Bull 1994; 20: 89-102.
Cannon M, Jones P. Neuroepidemiology review series. J Neurol Neurosurg Psychiatry 1996; 61: 604-613.
Cannon TD, Hollister JM, Bearden CE. y cols. A prospective cohort study of genetic and perinatal influences in schizophrenia. Arch Gen Psychiatry 1997; 24: 248.
Cannon M, Jones P, Murray RM, y cols. Childhood laterality and later risk of schizophrenia in the 1946 British birth cohort. Schizophr Res 1997; 26 (2-3): 117-20.
Cole P, MacMahon, B. Attributable risk percent in case-control studies. Br J Prev Soc Med 1971; 25: 242-244.
Conrad K. La esquizofrenia incipiente. Intento de un análisis de la forma del delirio. Madrid, Editorial Alhambra, 1958; 32.
Cornblatt BA, Keilp JG. Impaired attention, genetics an the pathophysiology of schizophrenia. Schizophr Bull 1994; 20: 31-46.
Crow TJ, Done DJ. Prenatal exposure to influenza does not cause schizophrenia. Br J Psychiatry 1992; 161: 390-393.
Crow TJ, Done DJ, Sacker A. Childhood precursors of psychosis as clues to its evolutionary origins. Eur Arch Psychiatry Clin Neurosci 1995; 245: 61-69.
Chapman JP. The early symptoms of schizophrenia. British Journal of Psychiatry 1966; 112: 225-251.
Chen WJ, Hsiao CK, Hsiao LL, y cols. Performance of the Continuous Performance Test among community samples. Schizophr Bull 1998; 24 (1): 163-174.
D’Angelo EJ, Krock LA, O’Neill LD, y cols. Developmental and temperamental characteristics of infants at risk for serious psychopathology. En: Frontiers of infant psychiatry. Eds.: JD Call, E Galenson, RL Tyson. New York, Basic Books, 1983; 2: 190-200.
David AS, Malmberg A, Brandt L, y cols. IQ and risk for Schizophrenia: a population-based cohort study. Psychol Med 1997; 27 (6): 1311-1323.
De Lisi LE, Neckers LM, Weinberger DR, y cols. Increased whole bvlood serotonin concentrations in chronic schizophrenia patients. Arch Gen Psychiatry 1981; 17: 471-477.
Done DJ, Crow TJ, Johnstone EC, y cols. Childhood antecedents of schizophrenia and affective illness: Social adjustment at ages 7 and 11. British Medical Journal 1994; 309: 699-703.
Doreste J, Gracia R, Rodríguez Pulido F. Epidemiología analítico-observacional en salud mental (I): estudios de cohortes. En: JL González de Rivera, F Rodríguez, A Sierra: El método epidemiológico en Salud Mental. Barcelona, Masson, S.A., 37-55.
Doreste J. Epidemiología analítico-observacional en salud mental (II): estudios casos-controles. En: JL González de Rivera, F Rodríguez, A Sierra: El método epidemiológico en Salud Mental. Barcelona, Masson, S.A., 57-71.
Eaton WW, Badawi M, Melton B. Prodromes and precursors: Epidemiologic data for primary prevention of disorders with slow onset American Journal of Psychiatry, 1995; 152: 967-972.
Ebel H, Gross G, Klosterkotter J, y cols. Basic symptoms in schizophrenic and affective psychosis Psychopatology, 1989; 22: 224-232.
Erlenmayer-Kimling L, Cornblatt B. High Risk research in schizophrenia: a summary of what has been learned. J Psychiatr Res 1987; 21: 451-463.
Faergman P. Psychogenic psychosis. London, Butterworths, 1963.
Fish B. Infant predictors of the longitudinal course of schizophrenic development. Schizophr Bull 1987; 13: 395-409.
Fish B, Marcus J, Hans SL, y cols. Infants at risk for schizophrenia: Sequalae of a genetic neurointegrative defect. Arch Gen Psychiatry 1992; 49: 221-235.
Frangou S, Sharma T, Alarcon G, y cols. The Maudsley Family Study II: Endogenous event-related potentials in familial Schizophrenia. Schizophr Res 1997; 23: 45-53.
Freedman LR, Rock D, Roberts SA, cols. The New York High-Risk Project: attention, anhedonia and social outcome. Schizophrenia Res 1998; 30: 1-9.
Friedman D, Squires-Wheeler E. Event-related potentials (ERPs) as indicators of risk for Schizophrenia. Schizophr Bull 1994; 20: 63-74.
García Roldán JL. Cómo elaborar un proyecto de investigación. Alicante, Secretariado de publicaciones de la Universidad, 1995; 86-93.
Geddes JR, Lawrie SM. Obstetric complications and schizophrenia: A metaanalysis. Br J Psychiatry 1995; 167: 786-793.
Gladis MM, Levinson DF, Mowry BJ. Delusion in Schizophrenia spectrum disorders: diagnostic issues. Schizophrenia Bulletin 1994; 20: 747-754.
Glover V. Maternal stress or anxiety in pregnancy and emotional development of the child. British Jounal of Psychiatry 1997; 171: 105-106.
Gottesman II, Shields J, Hanson DR. Schizophrenia: The epigenetic puzzle. New York, Cambridge University Press, 1982.
Gottesman II, Bertelsen A. Confirming Unexpressed Genotypes for Schizophre-nia. Arch Gen Psychiatry 1989; 46: 867-872.
Gottesman II, Moldin SO. Schizophrenia genetics at the millennium: cautious optimism. Clin Genet 1997; 52 (5): 404-407.
Gross G. The «basic» symptoms of schizophrenia. British Journal of Psychiatry 1989; 155 (7): 21-25.
Hanson DR, Gottesman II, Heston LL. Some possible childhood indicators of adult schizophrenia from children of schizophrenics. Br J Psychiatry 1976; 129: 142-154.
Harrison G, Owens D, Holton A, y cols. A prospective study of severe mental disorder in Afro-Caribbean patients. Psychol Med 1988; 18: 643-657.
Hollister JM, Mednick SA, Brennan P, cols. Impaired autonomic nervous system-habituation in those at genetic risk for schizophrenia. Arch Gen Psychiatry 1994; 51: 552-558.
Hollister M, Laing P, Mednick SA. Rhesus incompatibility as a risk factor for schizophrenia in male adults. Arch Gen Psychiatry 1996; 53: 19-24.
Holzman PS, Matthysse S. The genetics of schizophrenia: a review. Psychol Sci 1990; 1: 279-286.
Huber G, Gross G, Schüttler R, y cols. Longitudinal studies of schizophrenic patients. Schizophrenia Bulletin 1980; 6 (4): 592-605.
Huttunen MO, Niskanen P. Prenatal loss of father and psychiatric disorders. Arch Gen Psychiatry 1978; 35: 429-431.
Hyde TM, Weinberger DR. Seizures and Schizophrenia. Schizophr Bull 1997; 23 (4): 611-622.
Iacono WG, Moreau M, Beiser M, y cols. Smooth-pursuit eye tracking in first-episode psychotic patients and their relatives. J Abnorm Psychol 1992; 101: 104-116.
Isele R, Metz J, Malzacher M, y cols. Social disability in schizophrenia: the controlled perspective Burghölzi Study. European Archive Psychiatric Neurology Science 1985; 234: 356-384.
Jauch DA, Carpenter WT. Reactive psychosis: I. Does the DSM-III concept define a third psychosis? Journal of Nervous and mental Disease 1988; 176: 72-81.
Jenicek M, Cléroux R. Epidemiología. Principios, técnicas aplicaciones. Barcelona, Salvat, 1987; 131.
Jones P, Rodgers B, Murray R, y cols. Childhood developmental risk factors for schizophrenia in the 1946 national birth cohort. Lancet 1994; 344: 1398-1402.
Jones P, Rantakallio P, Hartikainen AL, y cols. Cerebral ventricles dimensions as risk factors for schizophrenia and affective psychosis: An epidemiological approach to analysis. Psychol Med 1994; 24: 995-1011.
Jones P, Cannon M. The new epidemiology of Schizophrenia. The Psychiatric Clinics of North America 1998; 21 (1): 1-25.
Jones P, Rantakallio P, Hartikainen AL, cols. Schizophrenia as a long-term outcome of pregnancy, delivery and perinatal complications: A 28-year follow-up of the 1966 North Finland general population birth cohort. Am J Psychiatry 1998; 155: 355-364.
Kagan J, Zentner M. Early Childhood Predictors of Adult Psychopatology. Harvard Rev Psychiatry 1996; Marzo/Abril: 341-350.
Kaplan HI, Sadock BJ, Grebb J. Kaplan and Sadock’s Synopsis of Psychiatry. Behavioral Sciences. Clinical Psychiatry. Kaplan HI, Sadock BJ, Grebb JA. Baltimore, Williams and Wilkins, 7.a Ed., 1994, 468-469.
Keefe RSE, Silverman JM, Mohs RC, cols. Eye tracking, attention and schizotypal symptoms in nonpsychotic relatives of patients with schizophrenia. Arch Gen Psychiatry 1997; 54: 169-176.
Keith SJ, Matthews SM. The diagnosis of schizophrenia: A review of onset and duration issues. Schizophrenia Bulletin 1991; 17 (1): 51-67.
Kendler KS, Gruenberg AM, Tsuang MT. A DSM-III Family Study of the nonschizophrenic psychotic disorders. Am J Psychiatry 1986; 143: 1098-1105.
Kendler KS, Diehl SR. Schizophrenia: Genetics. En: Kaplan HI, Sadock. B.j. (eds.): Comprehensive Textbook of Psychiatry, 6.a ed., Baltimore, Williams y Wilkins, 1995, 1: 942-957.
Kendler KS, McGuire M, Gruenberg AM, cols. The Roscommon Family Study. I. Methods, Diagnosis of Probands, and Risk of Schizophrenia in Relatives. Arch Gen Psychiatry 1993; 50: 527-540.
Kendler KS, McGuire M, Gruenberg AM, y cols. The Roscommon Family Study. II. The risk of nonschizophrenic nonaffective psychoses in relatives Arch Gen Psychiatry 1993; 50: 645-652.
Kendler KS, McGuire M, Guenberg AM, y cols. Outcome and family study of the subtypes of schizophrenia in the west of Ireland. Am J Psychiatry 1994; 151: 849-856.
Keshavan MS, Sharma T. La investigación sobre riesgo elevado en esquizofrenia: estado actual y futuro. En Esquizofrenia Monitor 1998; 1 (1): 1-4.
Keshavan MS, Montrose DM, Pierri JN, y cols. Magnetic Resonance Imaging and Spectroscopy in offspring at risk for schizophrenia: preliminary studies. Prog. Neuropsychophramacol. Biol Psychiatry 1997; 21 (8): 1285-1295.
King R, Faull KF, Stahl SM, y cols. Serotonin and Schizophrenia: correlations between serotonergic activity and schizophrenic motor behavior. Psychiatr. Res., 1985; 14: 235-240.
Kinney DK, Levy DL, Yurgelum-Todd DA, y cols. Season of birth and obstetrical complications in schizophrenics. J Psychiatr Res 1994; 28: 499-509.
Kinney DK, Levy DL, Yurgelun-Todd DA, y cols. Inverse relationship of perinatal complications and Eye Tracking Dysfunction in relatives of patients with Schizophrenia: Evidence for a two-factor model. Am J Psychiatry 1998; 155 (7): 976-978.
Kremen WS, Seidman LJ, Pepple JR, y cols. Neuropsychological risk indicators for schizophrenia: a review of family studies. Schizophr Bull 1994; 20: 103-119.
Kristenson H, Johnell O. Minor orthopedic disease: registration for alcoholism and serum gamma-glutamyltransferasa in men. Drug Alcohol Depend 1985; 15: 405-408.
Kumra S, Wiggs E, Krasnewich D, cols. Brief report: association of sex chromosome anomalies with childhood-onset psychotic disorders. J Am Acad Child Adolesc Psychiatry 1998; 37 (3): 292-296.
Levy DL, Holzman PS, Matthysse S, y cols. Eye tracking and Schizophrenia: a selective review. Schizophr Bull 1994; 20: 47-62.
Lewine RRJ, Watt NF, Prentky RA, y cols. Childhood social competence in functionally disordered psychiatric patients and in normals. Journal of Abnormal Psychology 1980; 89: 132-138.
Lewis SW, Owen MJ, Murray RM. Obstetrics complications and schizophrenia: Methodology and mechanisms. En: CA Schultz y CA Tamminga (eds.), Schizophrenia: a Scientific Focus. New York, Oxford University Press, 1989; 56-59.
Lewis G, David A, Andreasson S, y cols. Schizophrenia and city life. Lancet 1992; 340: 137-140.
Lindholm E, Cavelier L, Howell WM, y cols. Mitocondrial sequence variants in patients with schizophrenia. Eur J Hum Genet 1997; 5 (6): 406-412.
Lyons MJ, Toomey R, Meyer JM, cols. How do genes influence marijuana use? The role of subjective effects. Addiction 1997; 92: 409-417.
Maier W, Franke P, Hain C, y cols. Neuropsychological indicators of the vulnera-bility to schizophrenia. Prog Neuropsy-chopharmacol Biol Psychiatry 1992; 16: 703-715.
Maier W, Lichtermann D, Minges J, cols. Continuity and discontinuity of affective disorders and schizophrenia. Results of a controlled family study. Arch Gen Psychiatry 1993; 50: 871-883.
Malmberg A, Lewis G, David A, y cols. Premorbid adjustment and personality in people with schizophrenia. Br J Psychiatr 1998; 172: 289-290.
Marcelis M, Van Os J, Sham P, y cols. Obstetric complications and familial morbid risk of psychiatric disorders. Am J Med Genet 1998; 81 (1): 29-36.
Marcus J, Hans SL, Auerbach JG, cols. Children at risk for schizophrenia: The Jerusalem Infant Development Study. Arch Gen Psychiatry 1981; 38: 708-713.
Marcus J, Hans SL, Auerbach JG, y cols. Children at risk for schizophrenia: The Jerusalem Infant Development Study. Arch Gen Psychiatry 1993; 50: 797-809.
Marcuse Y, Cornblatt B. Children at risk for schizophrenia: predictions from infancy to adult functioning. En: Life-span research on the prediction of psychopathology. Eds.: L Erlenmeyer-Kimling, NE Miller, Hillsdale, Erlbaum, 1986; 81-100.
Matthysse S, Holzman PS, Lange K. The genetic transmission of schizophrenia: application of mendelian latent structure analysis to eye tracking dysfunction in schizophrenia and affective disorders. J Psychiatr Res 1986; 20: 57-76.
McNeil TF, Kaij L. Offspring of woman with nonorganic psychoses. En: Children at risk for schizophrenia: a longitudinal perspective. Eds.: NF Watt, EJ Anthony, LC Wynne, JE Rolf, Cambridge, Cambridge University Press, 1984; 465-481.
McNeil TF, Kaij L. Swedish High Risk Study: sample characteristics at age 6. Schizophr Bull 1987; 13: 373-382.
McGorry PD, Singh BS. Schizophrenia: Risk and possibility. En: Raphael B, Burrows GD. (eds.) Handbook of Preventive Psychiatry, New York, Elsevier, 1995; 492-514.
McGrath JJ, Murray RM. Risks factor for schizophrenia-from conception to birth. En: S Hirsch, D Weinberger (eds.) Schizophrenia Oxford, Blackwell, 1995; 187-205.
McGue M, Gottesman II, Rao DC. The transmission of schizophrenia under a multifactorial threshold model. American Journal of Human Genetics 1983; 35: 1161-1178.
McGuffin P, Asherson P, Owen M, y cols. The strength of the genetic effect: Is there room for an environmental influence in the aetiology of schizophrenia? Br J Psychiatry 1994; 164: 593-599.
Mednick SA, Schulsinger F. A longitudinal study of children with a high risk for schizophrenia: a preliminary report. En: S Vandenberg (ed.) Methods and Goals in Human Behavior Genetics. Orlando, Academic Press, Inc., 1965; 255-296.
Mednick SA, Mura E, Schulsinger F, y cols. Perinatal conditions and infant development in children with schizophrenic parents. Soc Bio 1971; 18: 103-113.
Mednick SA, Parnas J, Schulsinger F. The Copenhagen high-risk project. Schizophr Bull 1987; 13: 485-495.
Mednick SA, Machon RA, Huttunen MO, y cols. Adult Schizophrenia following prenatal exposure to an influenza epidemic. Arch Gen Psychiatry 1988; 45: 171-176.
Meijer A. Child psychiatric sequelae of maternal war stress Acta Psychiatrica Scandinavica 1985; 72: 505-511.
Miettinen OS. Estimability and estimation in case-referent studies. Am J Epidemiol 1976; 103: 225-235.
Moldin SO, Gottesman II. At Issue: Genes, experience and chance in Schizophrenia. Positioning for the 21st century. Schizophrenia Bulletin 1997; 23 (4): 547-561.
Mowry BJ, Nancarrow DJ, Levinson DF. The molecular genetics of schizophrenia: An update. Acta Psychiatr Scand 1997; 96 (5): 402-404.
Myhrman A, Rantakallio P, Isohanni M, y cols. Does unwantedness of a pregnancy predict schizophrenia? Br J Psychiatry 1996; 169: 637-640.
Nidecker A. Identificación de pacientes en riesgo. Clinical Psychiatric News 1999; 1 (1): 2.
O’Callagan E, Sham P, Takei N, y cols. Schizophrenia after prenatal exposure to the 1957 A2 influenza epidemic. Lancet 1991; 337: 1248-1250.
Ohara K, Xu HD, Mori N, y cols. Anticipation and imprinting in Schizophrenia. Biol Psychiatry 1997; 42 (9): 760-766.
Ohara K, Tani K, Tsukamoto T, y cols. Exclusion of five trinucleotide repeat (CAG and CCG) expansions in 17 families with Schizophrenia. Biol Psychiatry 1997; 42 (9): 756-759.
Ohman A, Hultman CM. Electrodermal activiy and obstetric complications in schizophrenia. J Abnormal Psychol 1998; 107 (2): 228-237.
Parnas J, Schulsinger F, Teasdale TW, y cols. Perinatal complications and clinical outcome within the schizophrenia spectrum. Br J Psychiatry 1982; 140: 416-420.
Price RA. Aspectos genéticos de la enfermedad mental. En: Bases biológicas de la Función Normal y patológica del Cerebro. A Frazer, P Molinoff, A Winokur (eds.), Barcelona, Espaxs 1995; 2: 317-336.
Ragins N, Schachter J, Elmer E, y cols. Sustained attention of children at risk for schizophrenia. J Am Acad Child Adolesc Psychiatry 1975; 14: 150-177.
Reveley AM, Reveley MA, Clifford CA, y cols. Cerebral ventricular size in twins discordant for schizophrenia. Lancet 1982; 1: 540-541.
Robins L. Deviant children grown up. Baltimore, Williams and Wilkins, 1966; 67.
Saudino KJ, McClearn GE, Pedersen NL, y cols. Can personality explain genetic influence on life events? Journal of Personality and Social Psychology 1997; 72: 196-206.
Sameroff AJ, Seifer R, Zax M. Early development of children at risk for emotional disorders. Monographs of the Society for Research in Child Development, 199. Chicago, University of Chicago Press, 1982.
Sameroff AJ, Seifer R, Zax M, y cols. Early indicators of developmental risk: Rochester Longitudinal Study. Schizophr Bull 1987; 13: 383-94.
Sentís J. La aplicación del método estadístico a la investigación epidemiológica. En: JL González de Rivera, F Rodríguez, A Sierra: El método epidemiológico en Salud Mental. Barcelona, Masson, S.A., 93-94.
Sham PC, O’Callaghan E, Takei N, y cols. Increased risk of schizophrenia following prenatal exposure to influenza. Br J Psychiatry 1992; 160: 461-466.
Suhr JA. Executive functioning deficits in hypothetically psychosis-prone college students. Schizophr Res 1997; 27 (1): 29-35.
Susser E, Lin P. Schizophrenia after prenatal exposure to the Dutch hunger winter of 1944-1945. Arch Gen Psychiatry 1992; 53: 25-31.
Susser E, Neugebauer R, Hoek HW, y cols. Schizophrenia after prenatal famine: Further evidence. Arch Gen Psychiatry 1996; 53: 25-31.
Van Os J. Risk factors in schizophrenia. En Clear Perspectives. Management Issues in Schizophrenia. Oxford, Zeneca Pharmaceuticals 1998; 2 (1): 1-5.
Van Os J, Selten JP. Prenatal exposure to maternal stress and subsequent schizophrenia. The May 1940 invasion of The Netherlands. Br J Psychiatry 1998; 172: 324-326.
Walker E, Lewine RJ. Prediction of adult-onset schizophrenia from childhood home movies of the patients. Am J Psychiatry 1990; 147: 1052-56.
Walker E, Grimes KE, Davis D, y cols. Childhood precursors of Schizophrenia. Facial expressions of emotion. Am J Psychiatry 1993; 150: 1654-1660.
Walker E, Savoie T, Davis D. Neuromotor precursors of Schizophrenia. Schizophr Bull 1994; 20: 441-451.
Watt NF. Longitudinal changes in the social behaviour of children hospitalised for schizophrenia as adults. Journal of Nervous and Mental Disease 1972; 155: 42-54.
Webb CT, Levinson DF. Schizotypal and paranoid personality disorder in the relatives of patients with schizophrenia and affective disorders: a review. Schizophr Res 1993; 11: 81-92.
Weinberger DR, DeLisi LE, Neophytides AN, y cols. Familial aspects of CT scan abnormalities in chronic schizophrenic patients. Psychiatry Res 1981; 4: 65-71.
Weinstock M, Fride E, Hertzberg R. Prenatal stress effects on functional development of the offspring. En: Progress in Brain Research. Eds.: GJ Boer, MGP Feenstra, M Mirmiran, y cols, Rotterdam, Elsevier, 1988; 73: 319-331.
Wyatt RJ, Murphy DL, Belmaker R, cols. Reduce monoamine oxidase activity in platelets: a possible genetic marker for vulnerability to schizophrenia. Science 1973; 173: 916-918.
Yung AR, McGorry PD, McFarlane CA, y cols. Monitoring
and Care of Young People at Incipient Risk or Psychosis. Schizophrenia
Bulletin 1996; 22 (2): 283-303.