Informaciones Psiquiátricas - Primer y segundo trimestres 2005. Número 179-180
Enfermedad de Alzheimer avanzada
Dr. Pedro Gil Gregorio
Servicio Geriatría. Hospital Clínico San Carlos. Madrid
Recepción: 04-04-05 / Aceptación: 12-04-05
La enfermedad de Alzheimer en fases severas o avanzadas se utiliza para clasificar a un paciente que ha alcanzado un estadio evolutivo caracterizado por afectación cognitiva grave y por depender de otras personas para la realización de todas las actividades básicas de la vida diaria.
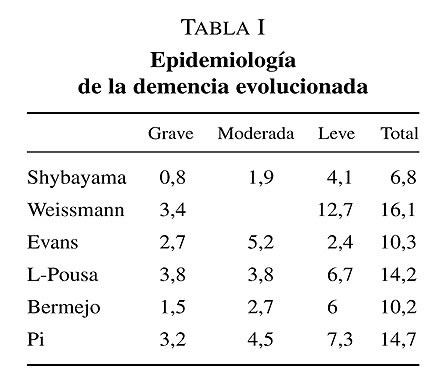
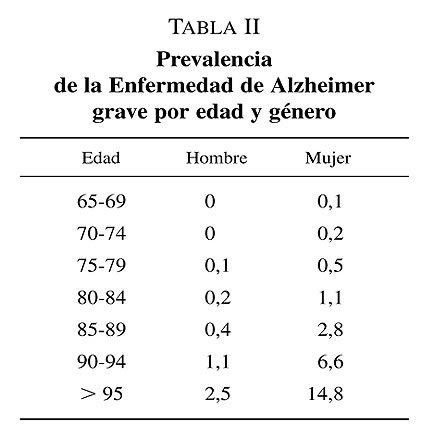
En la ultima década del pasado siglo la mayoría de los estudios epidemiológicos utilizaron los criterios clínicos DSM para diagnosticar la demencia, lo que permite realizar análisis conjuntos. Teniendo en consideración la definición aportada por esos criterios diagnósticos, cabe esperar que la mayoría de los casos que cumplen estas condiciones corresponden a demencia en fase avanzada. En el estudio Pamplona se llego a la conclusión que aproximadamente la mitad de los casos de demencia detectados en la población corresponden a una demencia en fase avanzada. En el estudio Toledo se obtuvo que la prevalencia de demencia grave era del 2,1% En la tabla I se exponen datos sobre prevalencia de las demencias en diferentes estadios evolutivos. En la tabla II se expone la prevalencia de demencia avanzada en función del género.
MANIFESTACIONES CLÍNICAS
La fase avanzada de la enfermedad aparece, como término medio, entre 10 y 12 años del comienzo de la enfermedad y se corresponde a los estadios histopatológicos V y VI de la clasificación de Braak and Braak sobre la progresión de los cambios neurofibrilares en las diferentes fases de la enfermedad.
Existe un consenso general en que, en las últimas fases de la enfermedad, cuando la cognición está mas gravemente afectada, son más importantes los trastornos de conductuales y las alteraciones funcionales.
Alteraciones cognitivas
La atención en las fases avanzadas de la enfermedad está gravemente afectada, es tal el déficit de atención que podría llegar a pensarse que el grado de conciencia se encuentra alterado.
La memoria sensorial y la de trabajo o inmediatas se mantienen de forma aceptable en las fases iniciales y decaen de forma significativa en las fases avanzadas. Parece que en la enfermedad de Alzheimer hay una pérdida escalonada tanto de la episódica como de la remota. En la fase avanzadas se encuentra afectada también la memoria autobiográfica. El deterioro de la memoria semántica es mayor en fases avanzadas. También la memoria implícita se pierde sólo en las fases avanzadas, lo contrario que en las demencias subcorticales.
Las alteraciones del lenguaje se presentan en el 40% de los casos de demencia leve o moderado y llega al 100% de los casos en las demencias avanzadas. Las alteraciones de la repetición como la ecolalia (repetición de la última palabra oída), la palilalia (repetición cada vez más rápida de una sílaba, palabra o frase corta) y las logoclónicas (repetición escandida o distónica de palabras) son típicas de las fases avanzadas. En el final de la evolución se llega de forma inexorable al mutismo.
Los aspectos ejecutivos de la cognición, como planificar, organizar y secuenciar, así como algunos aspectos de la atención se consideran funciones esencial y de alto nivel. En consecuencia, en las fases avanzadas de la demencia existe una marcada disfunción ejecutiva.
La apraxia constructiva, idemotoriz e ideatoria son muy evidentes en los estadios severos. La asomatognosia o incapacidad para reconocer el propio cuerpo y la agnosognosia o ignorancia de la propia enfermedad, suelen estar presentes en las fases avanzadas.
Alteraciones conductuales
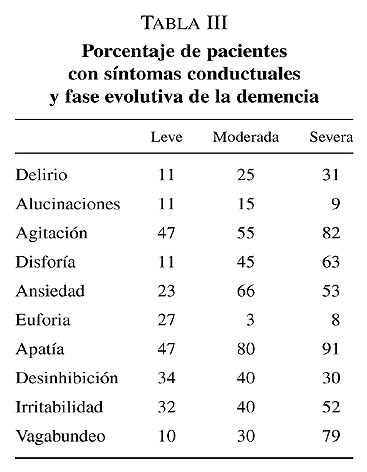
En las fases avanzadas la limitación del paciente para expresar su subjetiva emocional es un terreno abonado para la frustración y la mala interpretación del entorno. Los síntomas psicológicos son aquellos debidos a alteraciones de la percepción, contenido del pensamiento, humor o comportamiento, mientras que el componente conductual se detecta mediante la observación del paciente: agresividad, agitación, e inquietud entre otras. Como regla general, si bien en la demencia incipiente los aspectos psicológicos predominan sobre los conductuales, se puede afirmar que conforme avanza la demencia, el comportamiento conductual aumenta, mientras que los aspectos más puramente psicológicos tendrían más dificultad para expresarse y detectarse por los clínicos y cuidadores. En la tabla III se representan los diferentes síntomas psicológico-conductuales en función del estadio evolutivo.
Los trastornos conductuales se pueden agrupar en tres grandes grupos a) comportamientos agresivos físicos o verbales b) alteraciones físicas no agresivas como son la deambulación errante, y el síndrome del sundowing y c) agitación verbal.
Entre un 45% y un 69% de los pacientes con demencia presentan alteraciones del sueño. Entre las manifestaciones más típicas se encuentran: fragmentación del sueño, excitación nocturna, tiempo de sueño de onda lenta disminuido, alteraciones del ritmo circadiano y apnea del sueño. A éstos se pueden asociar somnolencia diurna y acentuación de la limitación cognitiva por dicha somnolencia.
Afectación funcional
La pérdida de la autonomía funcional para las actividades de la vida diaria sigue un patrón jerárquico de una forma relativamente fiel al proceso inverso del aprendizaje. En la enfermedad avanzada son las graves dificultades en las actividades básicas de la vida diaria las que dirigen las necesidades asistenciales del paciente. Posiblemente, la incontinencia urinaria, las alteraciones del equilibrio y de la marcha, los graves problemas de comunicación y los trastornos de la deglución sean los principales problemas funcionales en los últimos años de la evolución de la enfermedad de Alzheimer.
La incontinencia urinaria es, junto a los trastornos conductuales, el mejor predictor de riesgo de institucionalización. Se ha observado que existe una estrecha relación entre la incapacidad de copiar un dibujo y la presencia de incontinencia. El origen de la incontinencia asienta además de en trastornos locales de la vejiga urinaria en las dificultades en la orientación espacial y en la apraxia para realizar autónomamente las actividades relacionadas con la micción.
En las fases avanzadas de la enfermedad de Alzheimer, tanto la longitud de los pasos como la velocidad de la marcha están disminuidos. El rendimiento en las pruebas de equilibrio también es menor en estos pacientes. Se estima que el riesgo de sufrir una fractura es tres veces mayor para una persona con demencia que para la población general de iguales edad y género.
En los estadios severos los problemas de comunicación suponen un elemento añadido para los cuidadores habituales del paciente, no sólo porque dificultan el mantenimiento de vínculos afectivos, sino porque suponen una pérdida de información precisa para evaluar la calidad de los cuidados.
La disfagia es una complicación universal en los estadios más graves de la enfermedad de Alzheimer. En un estudio realizado sobre casi doscientos mil pacientes con demencia avanzada institucionalizados se observo que el 34% se alimentaban mediante sondas enterales.
VALORACIÓN CLÍNICA
La valoración de los pacientes con demencia en fases avanzadas debe cubrir las diferentes áreas o dominios que se encuentran alterados en los pacientes con demencia.
Dominio Cognitivo
En los últimos años, se han desarrollado escalas de evaluación cognitiva diseñadas específicamente para su aplicación en el segmento evolutivo final de la enfermedad de Alzheimer, cuando los instrumentos habituales o incluso los elementos de estadificicación dejan de ser discriminativos (tabla IV). El hecho de poder medir y discriminar a los pacientes con fases avanzadas es un requisito imprescindible para el estudio de la biología, fisiopatologia y, sobre todo, de cualquier posible tratamiento eficaz en estas fases.
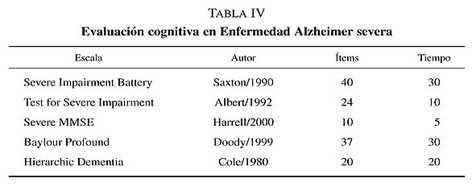
El Severe Impairment Battery, es un instrumento de fácil aplicación que consta de 40 ítems. Evalúa varias áreas cognitivas mediante 9 subescalas: interacción social, memoria, orientación, lenguaje, atención, praxias, función visoespacial, construcción y respuesta al nombre. Su correlación con el Mini Mental State Examination es de 0,71 al 0,81.
El Test for Severe Impairment es otra escala cognitiva de 24 ítems que examina memoria inmediata y diferida, el conocimiento general, el lenguaje, las habilidades sociales, la concepetualizacion y la ejecución motora. La correlación con el MMSE es de 0,83. Es una medida valida, fiable y sensible al cambio cognitivo, pero casi un tercio de los pacientes avanzados no pueden ser testados por falta de colaboración.
El Severe Mini Mental State Examination contiene 10 ítems centrados en las áreas cognitivas más conservadas en las fases avanzadas: conocimientos generales, lenguaje simple, fluidez verbal, función visoespacial elemental y capacidad para deletrear. Es muy fácil de aplicar en unos cinco minutos y sin ningún requerimiento de material especial. Tiene una buena validez de criterio y constructo aunque su correlación con el MMSE es sólo del 0,65.
Existen otros instrumentos de medida cognitiva aunque con menos difusión como el Baylor Profound Mental Status Examination, el Hierarchic Dementia Scale, la Bedford Alzheimer Nursing Severi-ty Scale y el Modified Ordinal Scales for Psychological Development.
Dominio Funcional
A medida que queda clara la importancia de la repercusión funcional, surge la necesidad de su cuantificación, por lo que se utilizan escalas funcionales, pero al igual como ocurre con los test cognitivos, existe en las fases más avanzadas de la enfermedad un efecto suelo que nos impide utilizarlos como discriminativos al cambio.
De la amplia gama de instrumentos existentes, es aconsejable el uso del Alzheimer’s Disease Cooperative Study Activities of Daily Livint modified for more severe dementia (ADCS-ADL sev) y el Disability Assessment for Dementia (DAD) en los estadios más avanzados de la enfermedad en la comunidad. El IDDD y el BADLS también pueden ser útiles en estadios algo más tempranos. No obstante, es preciso desarrollar nuevos tests funcionales, validar los ya existentes y consensuar escalas entre grupos de trabajo para lograr una homogeneización de los ensayos clínicos en los estadios avanzados.
Dominio conductual
Existen tres tipos de abordaje en el momento de evaluar los síntomas psicológicos y conductuales (tabla V).

Valoración de síntomas neuropsiquiátricos que están presentes en algunos instrumentos de evaluación global como la Clinical Interview- Based Impression of Change Plus Caregiver Imput (CIBIC-Plus), el Blessed Dementia Scale o la Clinical Global Impression of Change (ADCS-CGIC).
Instrumentos de evaluación que intentan valorar de forma integral los síntomas psicológicos y conductuales como el Neuropsychiatric Inventory (NPI). Este inventario se ha convertido en los últimos años en el instrumento más ampliamente utilizado. Consta de 12 subescalas, diez de las cuales evalúan distintas alteraciones psicopatológicas y dos miden síntomas neurovegetativos. El NPI dispone de una escala adicional que mide la repercusión que los síntomas psicológicos y conductuales tienen sobre los cuidadores.
Instrumentos diseñados para valorar un síntoma o conjunto sindromico como la depresión o la agitación.
Comorbilidad
La comorbilidad es extremadamente frecuente en pacientes con demencia y ésta aumenta con la gravedad de la demencia y con puntuaciones más bajas en el MMSE, es decir, con los estadios más avanzados de la enfermedad. El deterioro cognitivo de los pacientes dementes puede empeorar por un mal control de síntomas, un tratamiento inadecuado y el uso de fármacos que pueden empeorar la cognición y la neurodegeneración.
Los pacientes con enfermedad de Alzheimer en estadios precoces se quejan menos de problemas de salud que los controles, es posible que en estadios avanzados estas quejas se reduzcan todavía más y esto conduzca a una menor atención sanitaria.
Estadiaje
Para la estadificación de los déficit se han usado diferentes instrumentos, la mayoría de éstos derivados del estudio evolutivo de la enfermedad de Alzheimer. La utilización de estadificar las diferentes fases de la demencia es evidente, ya que ayuda al diseño terapéutico y a la planificación de los cuidados. Sin embargo, este hecho tiene como contrapunto la dificultad que supone la gran heterogeneidad clínica de la enfermedad, tanto por sus distintas etiologías como por la propia presentación clínica.
El número de instrumentos desarrollados hasta la actualidad es elevado, sin que pueda decirse que exista una elección. Entre los instrumentos globales de uso clínico se encuentran la Clinical Dementia Rating (CDR), el Functional Assessment Stating (FAST) y el Global Deterioration Scale. El FAST es especialmente útil en los estudios avanzados pues permite una subclasificación en los pacientes con demencia tipo Alzheimer graves y severos (tabla VI).

TRATAMIENTO FARMACOLÓGICO
El tratamiento actual de la enfermedad de Alzheimer y las estrategias farmacológicas a corto y medio plazo pasan por el avance en el conocimiento de las bases fisiopatológicas.
A partir de la fisiopatología conocida podemos esperar que el efecto beneficioso de los inhibidores de la acetil-colinesterasa perdure hasta el final de la vida, aunque probablemente en un grado progresivamente descendente en términos absolutos. Esta acción terapéutica atenúa el deterioro cognitivo y los síntomas psicológicos y conductuales, además de mejorar la capacidad funcional.
Existen dos motivos por los que existe una menor evidencia de la efectividad de los inhibidores de acetil-colinesterasa en al enfermedad de Alzheimer avanzada que en la menos evolucionada.
En primer lugar, al avanzar la enfermedad se va reduciendo la acetil-colinesterasa y el numero de neuronas colinérgicas, es lógico prever un menor efecto de unos fármacos que actúan potenciando la actividad de las neuronas supervivientes. El efecto, sin embargo, es previsible que persista hasta el final de la enfermedad, puesto que hay evidencias de que siguen existiendo células colinérgicas.
En segundo lugar, como actualmente disponemos de un fármaco aprobado para el tratamiento sintomático de la enfermedad evolucionada, resulta difícil iniciar ensayos doble ciego que comparen la efectividad de inhibidores de acetilcolinesterasa frente a placebo.
Los receptores NMDA forman parte de los receptores glutamatergicos ionotrópicos que controlan un canal que es permeable a iones mono y bivalentes, incluido el calcio.
La homeostasis alterada del calcio a nivel neuronal puede dar como resultado la muerte celular y la neurotoxicidad dependiente del calcio que deriva de una excesiva activación de receptores NMDA en el sistema nervioso central. En consecuencia, los antagonistas de receptores NMDA pueden prevenir la muerte celular y retrasar la presencia de síntomas en pacientes con demencia.
La memantina es un antagonista no competitivo, de moderada afinidad y voltaje dependiente de los receptores NMDA. Este fármaco bloquea los efectos de los valores tónicos patológicamente elevados de glutamato que pueden provocar disfunción neuronal. La memantina se ha demostrado su eficacia y buena tolerancia en el tratamiento de pacientes con enfermedad de Alzheimer en estadios moderadamente grave y grave. Nuevos estudios están demostrando también su utilidad en terapias combinadas con fármacos inhibidores de acetil-colinesterasa y en formas de demencia vascular. Próximamente podremos disponer de datos sobre la eficacia de este fármaco en los estadios leves-moderados.
FASE TERMINAL
La evolución de la demencia hasta la última fase obliga a realizar un cambio de rumbo, tanto en los planteamientos diagnósticos como terapéuticos, y en el enfoque de las situaciones del individuo cara al propio paciente, a los familiares e incluso al personal que lo asistirá.
De forma general, se identifica una serie de dilemas o quizás retos, en la asistencia al paciente con demencia terminal. Probablemente el reto más importante será el conocimiento de la propia demencia en sí, pero a modo de esquema, destacaremos los siguientes: establecimiento de predictores de mortalidad, pronóstico del paciente con demencia en fase terminal, inclusión en programas de cuidados paliativos, toma de decisiones terapéuticas, asistencia a los sentimientos de culpabilidad y ambivalencia familiar y qué hacer en el momento de la muerte.
Las decisiones que deben tomarse al final de al vida de un individuo deben centrarse, ante todo, en las directrices establecidas por él mismo, así como en sus deseos, preferencias y concepciones de la vida. En pacientes con demencias, en quienes la capacidad para decidir se pierde relativamente pronto y no existen posibilidades de predecir el final, la asesoría profesional al paciente y sus familiares, basada en las preferencias expresadas, en la evidencia científica y en el sentido común son fundamentales.
BIBLIOGRAFÍA
Agüero-Torres H, Thomas VS, Winblad B, Fratiglioni L. The impact of somatic and cognitive disorders on the functional status of the elderly J Clin Epidemiol 2002; 55: 1007-1012.
Aminoff BZ, Purits E, Noy S, Adunsky A. Measuring the suffering of end stage dementia: reliabiity and validity of the Mini-Suffering State Examination. Arch Gerontol Geriatr 2004; 38: 123-130.
Appolonio I, Gori C, Riva GP, Spiga S, Fedrrari A, Ferrarese C. Cognitive assessment of severe dementia: the test for severe impairment. Arch Gerontol Geriatr 2001; 33 (suppl 1) 25-31.
Barbarotto R, Cerri M, Acerbi C, Molinari S, Capitani E. Is SIB of BNP better than MMSE in discriminating the cognitive performance of severely impaired elderly patients Arch Clin Neuropsychol 2000; 15: 21-29.
Belleli G, Frisoni GB, Bianchetti A, Trabucchi M. The Bedford Alzheimer Nursing Severity scale for the severely demented: validation study Alzheimer Dis Assoc Disord 1997; 11: 71-77.
Blesa R, Davidson M, Kurz A, Reichman W, Van Baelen B, Schwalen S. Galantamine provides sustained benefits in patients with advanced moderate Alzheimer’s disease for at least 12 months. Dement Geriatr Cogn Disord 2003; 15: 79-87.
Boller F, Verry M, Hugonot L, Saxton J. Clinical features and assessment of severe dementia. A review. Eur J Neurol 2002; 9: 125-136.
Chen JC, Borson S, Scanlan JM. Stage specific prevalence of behavioral symptoms in Alzheimer’s disease in a multi-ethnic community sample Am J Geriatr Psychiatry 2000; 8: 123-133.
Chui H, Zhang Q. Evaluation of dementia: a systematic study of the usefulness of the American Academy of Neurology’s Practice Parameters. Neurology 1997; 49: 925-935.
Cummings JL. The neuropsychiatry of Alzheimer’s disease and related dementia. Martin Dunitz New York 2003.
Doraiswamy PM, Leon J, Cummings JL, Marin D, Neuman P. Prevalence and impact of medical comorbidity in Alzheimer’s disease. J Gerontol Med Sci 2002; 57 A: M173-M177.
Ferris H, Bing Y. Differential diagnosis and clinical assessment of patients with severe Alzheimer’s disease. Alzheimer Dis Assoc Disord 2003; 17 (Suppl 3) S92-S95.
Fillit H, Hill JW, Futterman R. Health care utilization and costs of Alzheimer’s disease: the role of co-morbid conditions, disease stage and pharmacotherapy Fam Med 2002; 34: 528-535.
Galasko DR, Schmidt FA, Jin S. Detalled assessment of cognition and activi-ties of daily living in modetate to severe Alzheimer’s disease Neurobiol Aging 2000; 21 (suppl 1) S168.
García FJ, Sánchez MI, Pérez A. Prevalencia de demencia y de sus subtipos principales en sujetos mayores de 65 años: efecto de la educación y ocupación. Estudio Toledo. Med Clin (Barc) 2001; 116: 401-407.
Gauthier S, Feldman H, Hecker J, Bellas B, Ames D. Efficacy of donepezil on behavioral symptoms in patients with moderate to severe Alzheimer’s disease. Int Psychogeriatr 2002; 14: 289-404.
Grossberg GT. The ABC of Alzheimer’s disease: behavioral symptoms and their treatment. Int Psychogeriatr 2002; 14 (Suppl 1) 27-49.
Harrell LE, Marson D, Chatterjee A, Parrish JA. The Severe Mini-Mental State Examination: a new neuropsychologic instrument for the bedside assessment of severely impaired patients with Alzheimer disease. Alzheimer Dis Assoc Disord 2000; 14: 168-175.
Hindmarch I, Lehfeld H, Jongh P. Bayer Activities Daily Living Scale (B-ADL) Dement Geriatr Cogn Disord 1998; 9 (Suppl 2) 20-26.
Lobo A, Launer LJ, Fratiglioni L. Prevalence of dementia and major subtypes in Europe: a collaborative study of population-based cohorts. Neurology 2000; 54 (Suppl 5) S10-S15.
Manubens JM, Martínez Lage JM, Lacruz F. Prevalence of Alzheimer’s disease and other dementing disorders in Pamplona. Neuroepidemiology 1996; 14: 155-164.
O’Hara R, Thompson JM, Kraemer HC, Fenn C, Taylor JL, Ross L. Which Alzheimer patients are at risk for rapid cognitive decline J Geriatr Psychiatry Neurol 2002; 15: 233-238.
Panisset M, Roudier M, Saxton J, Boller F. A battery of neuropsychological tests for severe dementia. An evaluation study Presse Med 1992; 21: 1271-1274.
Panisset M, Roudier M, Saxton J, Boller F. Severe Impairment Battery. A neuropsychological test for severly demented patients Arch Neurol 1994; 51: 41-45.
Patterson MB, Mack JL. CERAD Behavior Rating Scale for Dementia (BRSD) Alzheimer Dis Assoc Disord 2004; 11 (Suppl 2) 90-91.
Potkin SG. The ABC of Alzheimer’s disease: ADL and improving day-to-day functioning of patients. Int Psychogeriatr 2002; 14 (Suppl1) 7-26.
Prigerson HG. Costs to society of family caregiving for patients with end stage Alzheimer’s disease N Engl J Med 2003; 349: 1891-1892.
Reedsburg B, Finke S, Overall J, Schmidt-Galas N. The Alzheimer’s disease Activities Daily Living International Scale (ADL-IS) Int Psychogeriatr 2001; 13: 163-168.
Reisberg B, Doody R, Stoffler A. A randomized, placebo-controlled study of memantine, an uncompetitive NMDA antagonist in patients with moderate to severe Alzheimer’s disease N Engl J Med 2003; 348: 1333-1341.
Riviere S, Gillette-Guyonnet S, Andrieu S, Nourhashemi F, Lauque S, Cantet C. Cognitive function and caregiver burden: predictive factors for eating behaviour disorders in Alzheimer’s diseases Int J Geriatr Psychiatry 2002; 17: 950-955.
Rosen J, Burgio L, Kollar M, Cain M, Allison M. The Pittsburg Agitation Scale: a user friendly instrument for rating agitation in dementia patients. Am J Geriatr Pyschiatry 2004: 2: 54-59.
Scarpini E, Schettens P, Feldmand H. Treatment of Alzheimer’s disease current status and new perspectives Lancet Neurol 2003; 2: 539-547.
Scherder EJA, Sergeant JA, Swaab DF. Pain processing in dementia and its relation to heuropathology Lancet Neurol 2003; 2: 677-686.
Schneider LS. Validity and reliatibility of the Alzheimer’s disease Study Clinical Global Impression of Change (ADCS-CGIC). Alzheimer Dis Assoc Disord 2004; 2 (Suppl 1) S13-S23.
Sclan SG, Saillon A, Fransesen E, Reisberg B. The Behavioral Pathology in Alzheimer's disease Rating Scale (BEHAVE-AD) reliability and analysis of symptom category scores Int J Geriatr Psychiatry 2004; 11: 819-830.
Shah AK. Aggressive behaviour in the elderly Int J Psychiatr Clin Practice 2004; 3: 85-103.
Shuster JL. Palliative care for advanced dementia. Clin Geriatr Med 2000; 16: 2-16.
Snowden M, Sato K, Roy-Byrne P. Assessment and treatment of nursing home residents with depression of behavioural symptoms associated with dementia: a review of the literature. J Am Geriatr Soc 2003; 51: 1305-1317.
Tariot PN, Farlow MR, Grossberg GT, Graham SM, McDonald S, Gergel I. Memantine treatment in patients with moderate to severe Alzheimer’s disease already receiving donepezil: a randomized controlled trial JAMA 2004; 291: 317-324.
Volicer L. Management of severe Alzheimer’s disease and end of life issues Clin Geriatr Med 2001; 17.
Winblad B, Pontis N. Memantine in severe dementia: results of the 9M Best Study. Int J Geriatr Psychiatry 1999; 14: 135-146.
Yaffe K, Fox P, Newcomer R, Sands L, Lindquids K, Dane K. Patient and caregiver characteristics and nursing home placement in patients with dementia JAMA 2002; 287: 2090-2097.