Informaciones Psiquiátricas - Segundo trimestre 2006. Número 184
Farmacoterapia en la enfermedad de Alzheimer. Diez años después
Óscar Taboada Díaz
F.E.A. Psiquiatría.
Hospital de Día-Programa Sociosanitario. Hospital Juan Canalejo - A Coruña.
Recepción: 08-03-06 / Aceptación: 03-04-06
Cuando en 1994 se comercializó la tacrina, fármaco que confirmaba la hipótesis colinérgia, parecía que el tratamiento curativo de la demencia estaba muy cercano. Transcurridos más de diez años, en el panorama terapéutico habitual disponemos de tres inhibidores de acetilcolinesterasa (donepezilo, rivastigmina y galantamina) y de un antagonista del receptor glutamatérgico NMDA (memantina), pero somos conscientes de que todavía no hemos descubierto el mecanismo etiopatogénico de las demencias tipo Alzheimer y que sólo intervenimos en los tramos finales de las enfermedades.
Actualmente, cuando desconocemos parte del papel que desempeñan los ovillos neurofibrilares y las placas seniles, los frentes de investigación se han multiplicado. En primer lugar, se ha descubierto que la mayoría de los factores de riesgo de las demencias vasculares lo son también de la demencia tipo Alzheimer, con lo que ha cobrado gran importancia las medidas epidemiológicas asociadas que deben iniciarse años antes de la aparición del deterioro (estimular la actividad mental, restricción calórica, control de la tensión arterial, aspectos dietéticos, alcohol y tabaco). Afortunadamente, en pocos años ampliaremos nuestro arsenal terapéutico con fármacos que actúan en diferentes vías y fases de la enfermedad: inhibidores de Beta y Gamma secretasas, reguladores del colesterol, inhibidores de las caspasas que eviten la muerte apoptótica, agentes quelantes de metales, antiinflamatorios, neurotrofinas, inmunoterapia sin complicaciones asociadas y fármacos que inhiban la resistencia a la insulina cerebral.
Como conclusión, debemos prepararnos y pertrecharnos para luchar contra esta enfermedad, sabiendo que es un enemigo temible pero al que cada vez encontramos más puntos débiles, valorando que la enfermedad de Alzheimer sigue teniendo un inicio de presentación clínica tardío pero, posiblemente, precisa de una intervención multifactorial y precoz.
1. TRATAMIENTO FARMACOLÓGICO ACTUAL DE LA ENFERMEDAD DE ALZHEIMER
Introducción
La enfermedad de Alzheimer (EA) es un proceso degenerativo cerebral que causa el depósito de sustancias proteicas insolubles intra y extracelulares. Se considera que el depósito del péptido amiloide ab42 es el factor fundamental, aunque no único, para el desarrollo de la enfermedad. Este depósito se debe a un aumento de la producción de esta sustancia en los casos hereditarios, mientras que en los esporádicos el aumento se relaciona probablemente con una disminución de su aclaramiento.
1.1. El tratamiento sintomático colinérgico
La hipótesis colinérgica propone que los déficit cognitivos de la enfermedad de Alzheimer están relacionados con la disminución de la actividad acetilcolinérgica central y que el aumento de Ac Colina intrasináptico mejorará la función cognitiva, disminuyendo los trastornos comportamentales y la carga del cuidador. Los enfoques del tratamiento colinérgico han incluido la administración del precursor de Acetil Colina y la estimulación indirecta colinérgica. Por desgracia, la mayoría de estas estrategias colinérgicas han resultado ineficaces, a veces efectivas pero demasiado tóxicas o no se han desarrollado por completo.
La Acetil Colina permanece activa hasta que es hidrolizada por la acetilcolinesterasa (ACE) a colina y acetato. Inhibiendo la ACE y, con ello, la hidrólisis de la Acetil Colina, los IACE (Inhibidores de Acetil Colín Esterasa) incrementan de modo efectivo la cantidad de Acetil Colina disponible en la hendidura sináptica, facilitando así la neurotransmisión en los receptores nicotínicos y/o muscarínicos, lo que conlleva una mejora en la cognición.
La inhibición específica de la ACE puede tener lugar con inhibición asociada de la BCE (butirilcolinesterasa). La unión a la ACE puede ser reversible y puede ser competitiva o no con la Ach.
La ACE se presenta en varias formas moleculares: G4, un tetrámero, es el inhibidor de la ACE más abundante en el cerebro humano normal, pero su presencia en el cerebro disminuye un poco con la edad y, en mayor grado, en la enfermedad de Alzheimer. El G1, un monómero, se halla en las membranas postsinápticas del cerebro y participa en la degradación de la Ach independientemente de su liberación presináptica. Los receptores colinérgicos de las neuronas postsinápticas y la Ach monomérica G1 no disminuyen significativamente ni en la enfermedad de Alzheimer ni con el envejecimiento.
El efecto terapéutico de los IACE equivale al retraso de la evolución de los síntomas de la enfermedad de 1 a 2 años por promedio y a una disminución considerable de los síntomas psicológicos y conductuales, disminuyendo el uso concomitante de los psicotropos a partir del 1-2 mes de utilización.
Los metaanálisis (Cochrane) han ratificado la eficacia de todos los IACE frente a placebo an la EA, no encontrando diferencias significativas entre ellos. Se ha puntualizado que el número de pacientes que es necesario tratar para apreciar estabilidad clínica es de 7, mientras que es preciso tratar a 12 enfermos si pretendemos observar una leve mejoría y a 43 para tener un caso de eficacia clara. En el momento actual no se ha comprobado la eficacia de su uso en el deterioro cognitivo ligero.
1.1.1. Donepezilo
El donepezilo (Aricept®) es un piperidina con efecto inhibidor de la ACE de acción prolongada, relativamente selectivo y reversible y sin efectos hepatotóxicos. Por su semivida plasmática, se recomienda una sola toma diaria, aconsejando comenzar con 5 mg por la noche, aumentando a 10 mg al mes. Los efectos adversos más frecuentes son náuseas, diarrea, vómitos, insomnio, fatiga, diarrea y calambres musculares.
Actualmente existen estudios de seguimiento de enfermos tratados con donepezilo durante más de dos años que siguen teniendo efectos beneficiosos.
1.1.2. Rivastigmina
La rivastigmina (Exelon Prometax®) es un subtipo de inhibidor seudoirreversible de la ACE y de la BCE (Butiril Colín Esterasa), que incrementa sus niveles en fases avanzadas de la enfermedad, sobre todo en corteza entorrinal e inferotemporal. Aunque también inhibe ACE en tejidos periféricos, es cuatro veces más potente en el SNC y, dentro de él, en las áreas de la corteza y del hipocampo. Su metabolismo es esencialmente extrahepático, por lo que es improbable que sufra interacciones farmacocinéticas. La rivastigmina es un IACE que es además subselectivo para la forma monomérica G1 de la ACE.
Posiblemente sea el IACE que más frecuentemente produce efectos GI: náuseas, vómitos e hipoorexia, que por otra parte también pueden ocurrir con donepezilo y galantamina, por lo que se recomienda control del peso durante su titulación, que debe comenzar en 3 mg/d en dos tomas, aumentando mensualmente hasta 12 mg/d. Es fundamental recordar, que al igual que en el resto de los IACE, el «gold standard» aconseja llegar a la dosis máxima del inhibidor que no genere efectos secundarios significativos.
Se ha demostrado la eficacia de la rivastigmina en el tratamiento de la enfermedad con Cuerpos de Lewy y en la enfermedad de Parkinson asociada a demencia.
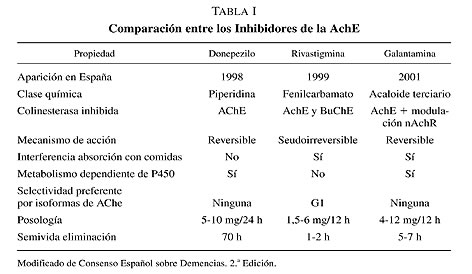
1.1.3. Galantamina
Galantamina (Reminyl) es un inhibidor reversible y competitivo de la ACE pero con una capacidad inhibitoria de la acetilcolinesterasa muy inferior al resto de los fármacos (30 veces menor) que no le hace ser menos efectivo en el tratamiento de la EA, posiblemente por un mecanismo asociado de modulación alostérica de los receptores nicotínicos presinápticos que podría compensar el defecto de los receptores muscarínicos y facilitar la liberación de acetilcolina.
Se recomienda titulación comenzando con 8 mg/d en dos tomas hasta 24 mg/d en medio de las comidas, aunque disminuya su velocidad de absorción, con el fin de disminuir los efectos secundarios GI.
Recientemente se ha aprobado la indicación en España de su uso en la demencia mixta (componente vascular), aunque posiblemente este efecto beneficioso aparezca también con el resto de los IACE y memantina.
1.2. Memantina
Memantina (Axura, Ebixa) es un antagonista no competitivo, con actividad moderada, de los receptores NMDA (N-metil-D-Aspartato) que están relacionados con numerosas funciones de plasticidad neuronal, como el aprendizaje y la memoria. Este fármaco disminuye la excitotoxicidad inducida por el glutamato, principal neurotransmisor excitatorio cerebral e implicado en los procesos de aprendizaje y memoria (neurotransmisión glutamaérgica en hipocampo) y en la neurodegeneración, ya que una actividad glutamaérgica excesiva tiene efectos neurotóxicos, posiblemente mediados por un aumento de Ca en el interior de las neuronas.
El clorhidrato de memantina se metaboliza en una proporción muy baja y es eliminado principalmente por el riñón (75-90%), aconsejando disminuir a la mitad la dosis en pacientes con insuficiencia renal, tardando unos 12 días en alcanzar concentraciones estables a partir de las cuales comienza a objetivarse la respuesta farmacológica.
La dosis de mantenimiento es de 20 mg/ día, en 2 tomas tras un escalado semanal de 5 en 5 mg durante 4 semanas, comenzando el tratamiento por la mañana. Actualmente su empleo está autorizado en las fases moderadas - graves de la demencia tipo Alzheimer (GDS 5-6-7) pudiendo emplearse con un MMSE menor de 20 y permitiendo su uso concomitante con IACE en las fases moderadas y moderadamente graves. En general, memantina es un fármaco bien tolerado. Las reacciones adversas más comunes incluyen agitación, incontinencia urinaria, diarrea, insomnio, vértigo, dolor de cabeza y alucinaciones.
Uno de las características destacables de los resultados del tratamiento con memantina en los enfermos en fases avanzadas radica en la ventaja farmacoeconómica que representa para las familias, que pueden llegar a disminuir el tiempo que precisan de cuidar al paciente en más de 50 horas al mes.
1.3. Antioxidantes
Aunque en un ensayo clínico se puso de manifiesto que la vit E parecía retardar la institucionalización en mayor medida que la selegilina y la combinación de ambos, otros estudios no han sido tan concluyentes, alertando del posible riesgo de mortalidad en dosis superiores a 400 mg/d de vit E.
El Gingko biloba ha mostrado, en un estudio controlado con placebo de un año de seguimiento, una leve mejoría en relación con el placebo, posiblemente al reducir la agregación del péptido B amiloide.
Es importante destacar que estos fármacos podrían utilizarse en un segundo nivel y no como primera opción terapéutica.
2. ENFOQUES PREVENTIVOS
Durante los últimos años se ha producido un avance significativo en el conocimiento fisiopatológico de la enfermedad de Alzheimer (EA) que ha llevado a formular diversas hipótesis, entre las que destaca la de la cascada amiloide. La mayoría de las estrategias terapéuticas y preventivas en investigación actualmente se centran en bloquear una o varias de las vías de la cascada. Todas estas estrategias pueden ser consideradas como un tratamiento precoz o a lo sumo una prevención secundaria, ya que actuamos una vez se ha iniciado el proceso patogénico. El objetivo más importante en cualquier patología es la prevención primaria para evitar que se inicie el proceso patogénico de la enfermedad. ¿Se puede prevenir la EA? ¿Podemos tomar alguna medida preventiva que reduzca la incidencia de la EA?
2.1. Actividad intelectual y física
Katzman propuso en 1993 la hipótesis de la reserva cerebral, según la cual la educación podría aumentar la densidad sináptica neocortical, retrasando los síntomas de EA hasta en 4-5 años. Más tarde Stern proponía la hipótesis de la reserva cognitiva, que postulaba que los sujetos con mayor nivel de estudios y mejor condición laboral podían hacer frente a los cambios patológicos de la enfermedad, manteniendo su actividad funcional durante más tiempo.
El famoso Nun Study estudió los cerebros de 93 monjas que tenían escritas autobiografías al ingresar en la orden religiosa. Se valoró la densidad de ideas y la complejidad gramatical de estas autobiografías, observando una fuerte relación entre la capacidad lingüística en la juventud y la función cognitiva y la EA, junto con mayor número de ovillos neurofibrilares en hipocampo, lo que les llevó a postular a los autores que la baja capacidad lingüística sería una expresión precoz de la enfermedad.
El estudio de envejecimiento del Bronx, con un seguimiento de hasta 21 años, muestra que la lectura, los juegos de mesa, los instrumentos musicales y el baile, pero no otras actividades físicas, se relacionaron con un menor riesgo de demencia vascular y EA.
Tras los hallazgos epidemiológicos, se planteó la realización de un ensayo clínico con entrenamiento cognitivo que demostró que el entrenamiento a sujetos sanos mayores de 65 años consigue una mejoría en las actividades entrenadas en los dos años siguientes. Sin embargo, esta mejoría no logra ser demostrada en las actividades de la vida diaria, probablemente por la escasa pérdida de capacidades en estos dos años en el total de los grupos.
Todos estos hallazgos en conjunto demuestran claramente un beneficio de la actividad intelectual desde edades tempranas, por lo que se debe recomendar una intensa y prolongada actividad intelectual desde la infancia hasta edades más avanzadas, así como una participación en actividades sociales, de ocio y físicas que, por una parte, mejoran la calidad de vida y, por otra parte, protegen en cierta medida frente a la aparición de los síntomas de demencia.
2.2. Dieta
Existen resultados dispares, pero con una clara tendencia a mostrar el factor protector de las grasas procedentes del pescado y como factor de riesgo las grasas saturadas y el colesterol de la dieta. La ingesta elevada de calorías y de grasas se relacionó con una mayor incidencia de EA en sujetos con APOE4 positivo. Este efecto puede ser debido a que el estrés oxidativo aumenta a mayor ingesta calórica, promoviéndose un mayor contenido intracelular de beta amiloide.
Aunque los resultados de los estudios no son definitivos, podemos orientar a nuestros pacientes a que realicen una dieta baja en grasas saturadas, con vegetales y frutas con contenido antioxidante, sin exceso de calorías y con contenido de ácidos grasos omega-3 al menos una vez a la semana, además de ser saludable desde el punto de vista cardiovascular, puede proteger frente a la EA. Recientemente se han publicado posibles efectos beneficiosos de la curcumina (contenida en la salsa curry) y del epigallocatechin-3-gallate, principal constituyente polifenólico del té verde.
2.3. Tabaco y alcohol
El EURODEM, metaanálisis de los estudios europeos, confirmó el mayor riesgo que tienen los fumadores de sufrir EA.
El estudio Rotterdam muestra que los sujetos que consumían al menos dos bebidas alcohólicas por día tenía menos riesgo de sufrir EA y demencia vascular que los que no consumían nada, debido a una posible reducción de factores de riesgo cardiovascular, el efecto inhibidor del etanol sobre las plaquetas, la alteración del perfil sérico de lípidos y una posible liberación de acetilcolina en el hipocampo.
2.4. Homocisteína, vitamina B y ácido fólico
La homocisteína puede tener un efecto neurotóxico activando el receptor NMDA, o un efecto excitotóxico al convertirse en ácido homocisteico.
Es relevante el estudio de Framinghtan, que demostró una fuerte y elevada asociación entre niveles elevados de homocisteína y EA, aumentando el riesgo hasta un 40%.
Los niveles de homocisteína pueden ser normalizados con suplementos de ácido fólico aislado o en combinación con vitamina B6 y B12.
2.5. Hipertensión arterial
Globalmente, todos los estudios demuestran una relación directa de la HTA desde edades medias y de la hipotensión arterial diastólica en edades avanzadas con la EA. El primer ensayo randomizado que demuestra una protección de los antihipertensivos es el Syst-Eur, que demuestra una reducción del 50% de riesgo de EA en sujetos tratados con nitrendipino en un seguimiento de tan sólo dos años.
El proyecto Kungsholmen realiza un análisis de la TA, el genotipo y el tratamiento antihipertensivo sobre sujetos mayores de 75 años. La HTA sistólica y la hipotensión diastólica son factores de riesgo, el genotipo APOE4 aumenta el riesgo en ambas situaciones y el tratamiento antihipertensivo disminuye el riesgo que confiere el genotipo en los sujetos hipertensos.
2.6. Lípidos y estatinas
Se han publicado diferentes revisiones que valoran el posible efecto protector de las estatinas disminuyendo el riesgo de la enfermedad de alzheimer hasta en un 50%. Hasta que se demuestre con seguridad el efecto preventivo es recomendable su uso para el tratamiento de la hipercolesterolemia en edades medias de la vida.
2.7. Estrógenos
Los estrógenos pueden disminuir el daño neuronal estimulando neuronas colinérgicas, por mecanismos antioxidantes, inhibiendo la producción del péptido amiloide AB42 y debido a sus efectos cardiovasculares.
Un metaanálisis que analiza dos estudios de cohortes y 10 estudios de casos y controles muestra una reducción del 34% del riesgo de sufrir EA. Más recientemente, un estudio prospectivo con un seguimiento de 3 años, muestra una reducción de la incidencia de EA en las mujeres con terapia sustitutiva.
En Estados Unidos se comenzó un ensayo clínico que preveía mantener el tratamiento durante 8,5 años, pero se paralizó por mayor riesgo de cardiopatía, ictus, embolismo pulmonar y cáncer de pulmón por lo que la utilización de estrógenos en el momento actual no es recomendable.
2.8. Antiinflamatorios no esteroideos (AINE)
El estudio realizado en Baltimore de forma prospectiva, con un seguimiento de 15 años, muestra una reducción del riesgo de sufrir EA en sujetos que utilizan AINE, que aumenta con el tiempo de exposición. Los autores plantean que los AINE pueden reducir el riesgo de sufrir EA si se utilizan durante una «ventana crítica» en los estadios latentes de la enfermedad, pudiendo preceder esta ventana varios décadas al inicio de la demencia. Otro gran estudio poblacional, con un seguimiento medio de 6,8 años, muestra que el riesgo de sufrir EA se reducía significativamente en los sujetos que consumían AINE durante 24 meses o más.
3. TERAPÉUTICAS EMERGENTES Y FUTURAS LÍNEAS DE INTERVENCIÓN
La enfermedad de Alzheimer es una proteinopatía muy compleja en la que intervienen preferentemente la proteína precursora de amiloide (APP), su producto (el péptido amiloide B), las presenilinas 1 y 2 (PS1 y PS2), la proteína asociada a microtúbulos llamada tau y la apolipoproteína E (apo E). El 95% de los casos de la enfermedad son resultado de una interacción entre múltiples genes predisponentes y factores de riesgo ambientales entremezclados con circunstancia al azar. Ante este panorama, aparecen múltiples dianas terapéuticas cuyos posibles efectos pueden influir en la evolución de la enfermedad.
3.1. Actuación sobre las secretasas
Las secretasas son un grupo variado de proteinasas que cortan la proteína precursora de amiloide. La alfa secretasa promueve la vía no amiloidogénica del metabolismo de la APP, por lo que se debería de intentar estimular su función mientras que por otra parte la inhibición de las Beta y Ganma secetasas serían las otras estrategias que evitarían la vía amiloidogénica con la disminución de péptido beta amiloide.
3.2. Inmunoterapia
Los ensayos clínicos con AN1792 (Antígeno compuesto por el pétpito AB humano completo de 1-42 aminoácidos) se paralizó en la fase II a porque 17 de los 375 enfermos que participaron en un ensayo multicéntrico, aleatoria frente a placebo, desarrollaron meningoencefalitis, aunque en la necropsia de dos de los fallecidos llamaba la atención las escasas placas seniles que aparecían en neocórtex con una respuesta inflamatoria con meningoencefalitis CD41, persistencia de ovillos neurofibrilares y la extensa infiltración macrofágica de la sustancia blanca.
3.3. Apoptosis y caspasas
La muerte neuronal de las enfermedades neurodegenerativas es por apoptosis (suicidio o muerte neuronal programada) que se produce porque se inicia una cascada bioquímica que activa las proteasas y destruye las moléculas necesarias para la supervivencia neuronal. Los responsables principales de la apoptosis son las proteasas llamadas caspasas.
La minociclina es una tetraciclina de segunda generación que inhibe la caspasa 1 y la microgliosis reactiva. Está siendo evaluada clínicamente en pacientes con esclerosis lateral amiotrófica y enfermedad de Huntington y se están diseñando ensayos clínicos en pacientes con Alzheimer.
3.4. Agentes Quelantes de los metales
Parece ser que la proteína AB no se agrega espontáneamente, sino que depende de un exceso de metales (Cu, Fe, Zn) en el cerebro, que aumenta con la edad, con lo que provoca la precipitación de la proteína enriquecida en tales metales formando las placas. Existen compuestos que se unen a tales metales e inhiben la peroxidación causada por AB y corrigen su agregación. Uno de ellos es el clioquinol, que con suplemento de cianocobalamina para prevenir una mielopatía, se están probando en fases experimentales.
3.5. Neurotrofinas
Existen estudios preliminares de inyección uni o bilateral en el núcleo basal de Meynert de fibroblastos cutáneos autólogos transfectados con el gen humano de NGF en ocho pacientes que después de 22 meses, demostró resultados positivos en 6 pacientes con aumento de metabolismo cortical en la PET.
3.6. Insulina y Antidiabéticos
El enzima que degrada la insulina degrada también el AB y es muy importante para mantener la señalización de insulina. En la EA puede haber una resistencia a la insulina cerebral. Los péptidos parecidos al glucagón (GLP-1) que refuerzan la proliferación pancreática de las células beta de los islotes, pueden ser agentes apropiados a este fin.
3.7. Antiinflamatorios y Reguladores del Colesterol
Comentados en el apartado anterior.
3.8. Minimoléculas de ARN
La interferencia de ARN, que utiliza la inyección intravenosa de diminutas moléculas truncadas de ARN, con el fin de silenciar la expresión de genes específicos, podría llegar a utilizarse en el tratamiento del Alzheimer familiar, causado por mutaciones de los genes de las presenilinas, de las mutaciones que originan taupatías e incluso para evitar la hiperfosforilación de tau en el Alzheimer familiar o esporádico de inicio tardío.
CONCLUSIONES
Actualmente, tras diagnosticar a un paciente con EA, tenemos la obligación de utilizar el tratamiento más eficaz a nuestro alcance (IACE y memantina) evitando un nihilismo terapéutico tomando conciencia de la eficacia de estos fármacos en la función cognitiva y sobre todo, en la disminución de los síntomas psiquiátricos y conductuales.
Por otra parte, deberíamos introducir en nuestras recomendaciones a nuestros pacientes, desde las primeras décadas de la vida, medidas higiénico dietéticas preventivas que seguramente disminuirán la incidencia de la EA, animándoles a llevar una variada actividad intelectual y física, a consumir una dieta baja en grasas saturadas, sin exceso de calorías y con contenido de ácidos grasos omega-3, a abandonar el tabaco y consumir 1-2 vasos de vino a partir de edades medias, a controlar y tratar HTA desde edades medias evitando la hipotensión en mayores de 75 años y a detectar la hipercolesterolemia y tratarla con estatinas desde edades medias.
BIBLIOGRAFÍA
Martínez Lage JM, y Colaboradores. Alzheimer XXI: Ciencia y Sociedad. Editorial Masson. Año 2001.
Agüera Ortiz L, Martínez Carrasco M, Cervilla J. Psiquiatría Geriátrica. Editorial Masson. Año 2001.
Alberca R, López Pousa S. Enfermedad de Alzheimer y Otras Demencias. 2.a Edición. Editorial Panamericana. Año 2002.
Martínez Lage JM, Pascual Millán LF. Alzheimer 2003: ¿Qué hay de nuevo? Aula Médica Ediciones. Año 2003.
Evidence based dementia practice. Nawab Qizilbash et al. Blacwell Publishing. 2003.
Martínez Lage JM, Del Ser Quijano T. Alzheimer 2004: La Pragmática necesaria. Aula Médica. Ediciones. Año 2004.
Consenso Español Sobre Demencias. 2.a Edición. SEPG. Saned. 2005.
López Pousa S, Turón A, Agüera LF. Abordaje Integral de las Demencias en fases avanzadas. Prous Science. Año 2005.