Informaciones Psiquiátricas - Segundo trimestre 2007. Número 188
Depresión de inicio tardío y patología vascular: entre los límites de la demencia y la depresión vascular*
Luis María García Santos
Psiquiatra.
Servicio de Psiquiatría. Hospital Nra. Sra. de la Misericordia. Toledo.
Augusto Zafra Villena
Psiquiatra.
Servicio de Psiquiatría. Hospital de La Ribera. Alzira. Valencia.
Recepción: 26-02-07 / Aceptación: 02-04-07
INTRODUCCION
Recientemente se ha estudiado con gran interés la depresión de inicio tardío para la que se ha propuesto un origen vascular, de tal manera que muchos autores la han denominado depresión vascular1. En este sentido los términos y conceptos de depresión vascular y demencia vascular hacen referencia a la implicación fundamental de la isquemia de la sustancia blanca y de determinadas estructuras encefálicas (núcleos grises de la base) en su patogénesis. Es por tanto una definición basada inicialmente en criterios de neuroimagen, en la que se postula que el trastorno cerebrovascular puede contribuir al desarrollo de un síndrome depresivo de inicio tardío2, 3.
Las características clínicas de la depresión vascular fueron propuestas por Alexopoulos y cols. en 19974 y consisten en:
Características cardinales
-
Evidencia clínica de enfermedad vascular o de factores de riesgo vascular.
-
Presencia de lesiones cerebrales isquémicas detectadas por neuroimagen.
-
Inicio de la depresión a edad tardía o cambio en la misma.
Características secundarias
-
Deterioro cognitivo, sobre todo, frontal.
-
Enlentecimiento psicomotor.
-
Ideación depresiva limitada.
-
Baja conciencia de enfermedad.
-
Ausencia de historia familiar de trastorno afectivo.
-
Impedimento o minusvalía física.
Posteriormente, Steffens y Khrisnan en 1998 elaboraron los criterios clínico-radiológicos de la depresión vascular:
Criterio A y al menos 1 de los 3 criterios B
A. Depresión mayor con lesiones en la neuroimagen o déficit neuropsicológico.
B1. Historia previa de ACV y/o signos neurológicos focales.
B2. Neuroimagen con hiperintensidades en sustancia blanca o gris, lesiones confluentes en sustancia blanca o infartos corticales o subcorticales.
B3. Trastornos cognoscitivos que incluyen alteración de las funciones ejecutivas (planificación, organización, abstracción), de la memoria y de la velocidad de procesamiento de la información.
El diagnóstico se ve reforzado por:
-
Un episodio depresivo después de los 50 años.
-
Historia familiar ausente de trastornos afectivos.
-
Reducción de las actividades instrumentales o de la autonomía personal.
En ancianos que presentan clínica depresiva de aparición tardía, sin antecedentes de trastornos afectivos, es frecuente el hallazgo de lesiones vasculares en sustancia blanca y núcleos grises subcorticales. Al realizar el seguimiento de estos pacientes, sin deterioro cognitivo al inicio del cuadro, es frecuente observar que algunos de ellos acaben desarrollando una demencia5.
La presencia de deterioro cognitivo, sobre todo frontal, en pacientes depresivos mayores de 65 años es mayor en pacientes depresivos con patología vascular6.
Tanto el trastorno depresivo como el deterioro cognitivo se deben a las pérdidas neurodegenerativas en los circuitos frontosubcorticales7. Cummings (2003), describe tres circuitos frontosubcorticales que vinculan las regiones del lóbulo frontal con las estructuras subcorticales y viceversa (figura 1).
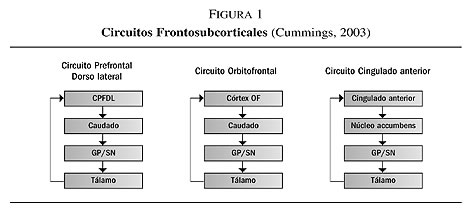
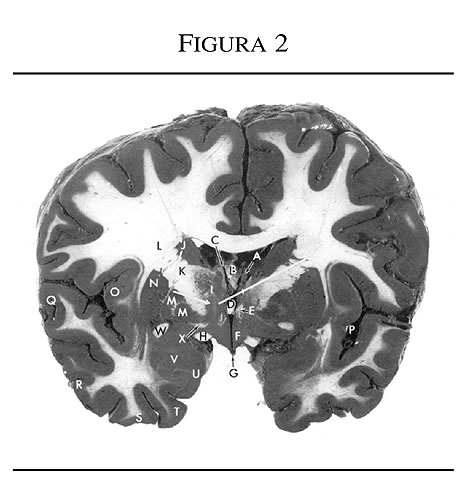
Cada uno de estos circuitos comienza en un área definida separada del córtex frontal y se proyecta a áreas concretas del cuerpo estriado (caudado, putamen o accumbens); de estas regiones, a su vez, se proyectan a áreas definidas de la sustancia negra o del globo pálido; de ahí a los diferentes núcleos del tálamo, y de las neuronas talámicas de vuelta a las regiones corticales frontales (figura 2).
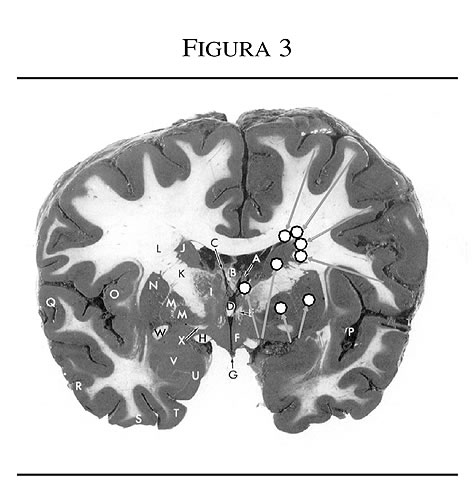
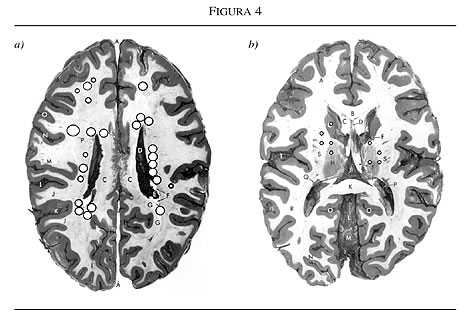
Los circuitos frontosubcorticales son vulnerables a varios tipos de patologías como las enfermedades cerebrovasculares (figuras 3 y 4).
Alexander y cols. (1986) demostraron que la alteración de los circuitos que conectan los ganglios basales con la corteza prefrontal tiene tres consecuencias: alteración psicomotora, alteración cognitiva y depresión8.
Parker (2000), considera la alteración psicomotora observable como marcador de superficie de un proceso neuropatológico subyacente, llamado melancolía. Como marcador, indica la presencia de una probable lesión o alteración neurobiológica9. Esta formulación se basa en el modelo de los circuitos neurales. Plantea la existencia de dos mecanismos diferentes:
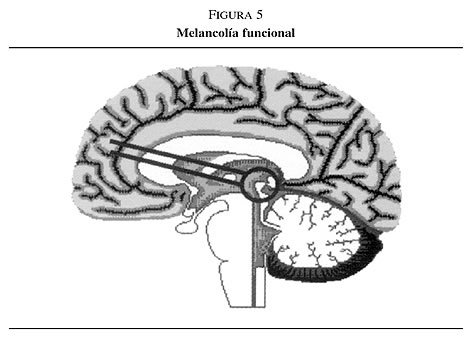
1. Aquellos pacientes que desarrollan depresión con alteración psicomotora a una edad temprana: Tienen numerosos antecedentes familiares de depresión, los estudios estructurales por la imagen rara vez permiten observar alguna anomalía y los pacientes suelen responder sin problemas a los fármacos antidepresivos y a la terapia electroconvulsiva (TEC). En este caso, el estrés desencadena una alteración en la fisiología de estos circuitos en sujetos con predisposición genética a la melancolía. A este proceso se le conoce como melancolía funcional (figura 5).
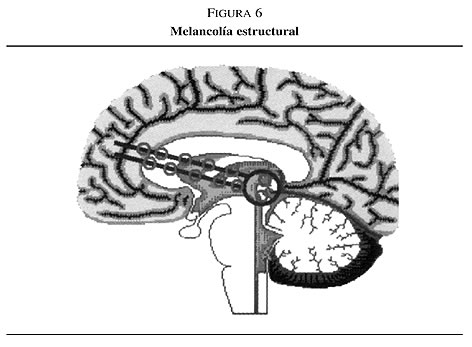
2. Aquellos pacientes que de entrada desarrollan una depresión y en los que las alteraciones psicomotoras aparecen en etapas más tardías de la vida: Los antecedentes familiares de depresión son menos frecuentes, mientras que los sujetos tienen mayores probabilidades de presentar antecedentes familiares y/o mayor número de factores de riesgo de trastornos cerebrovasculares. En este caso, es más probable que el circuito neural esté estructuralmente alterado (el caudado y el putamen suelen presentar un volumen reducido y se observan hiperintensidades indicativas de lesiones microvasculares que afectan a los circuitos). Estos pacientes suelen responder peor a los fármacos antidepresivos y pueden desarrollar ideas delirantes en respuesta a una dosis estándar de un antidepresivo tricíclico (ADT) o a la TEC, y su depresión podría presagiar una futura demencia. A este proceso se le conoce como melancolía estructural (figura 6).
Las alteraciones encontradas en las imágenes de RM de pacientes con depresión de inicio tardío se han localizado en forma de áreas de señal hiperintensa en la sustancia blanca y en la sustancia gris subcortical a nivel de los núcleos caudado, putamen y pálido2, 5, 10, 11, 12.
Las alteraciones a nivel de la sustancia gris subcortical se han relacionado con:
-
El envejecimiento normal.
-
Mayor severidad de los episodios depresivos de inicio tardío, pérdida de interés, inhibición psicomotriz y menor velocidad de procesamiento en los test neuropsicológicos.
-
La presencia de aterosclerosis sistémica y factores de riesgo vascular.
-
Mayor riesgo de delirium por fármacos antidepresivos y TEC.
Las señales hiperintensas localizadas a nivel de sustancia blanca periventricular se asocian a:
-
Enfermedad de Alzheimer con trastorno orgánico vascular.
-
Envejecimiento normal.
-
Depresión.
-
Alteraciones de la marcha.
-
Deterioro cognitivo sin demencia.
Las señales hiperintensas localizadas a nivel de sustancia blanca profunda serían más específicas de depresión.
OBJETIVOS
1. Describir las condiciones que acompañan a los pacientes que presentan depresión de inicio tardío.
2. Describir la localización de las hiperintensidades en las imágenes RM de este tipo de pacientes.
ESTUDIO DESCRIPTIVO
El estudio que hemos realizado es de características descriptivas. Los 20 pacientes incluidos en la muestra corresponden a enfermos que son atendidos de forma regular en las consultas externas de salud mental del Hospital Ntra. Sra. de la Misericordia (Toledo).
La muestra seleccionada (N = 20) cumple los criterios clínico-radiológicos de Steffen y Krishnan de depresión vascular (1998). Asimismo los pacientes tenían una edad mayor de 65 años, con independencia del sexo; no existía historia personal ni familiar de trastorno afectivo y padecían un primer episodio depresivo.
Entre las características clínicas que presentaban los pacientes destacaba: ideación depresiva limitada con escasa conciencia de enfermedad, marcado perfil apático-amotivacional y anhedonia.
Por otra parte existía una clara merma en su funcionamiento personal, sobre todo para la realización de las actividades cotidianas, acompañado de enlentecimiento psicomotor y alteración cognitiva. Estas alteraciones eran corroboradas frecuentemente por los familiares de los pacientes.
Con la muestra seleccionada (N = 20) realizamos una descripción de las circunstancias que acaecían en este tipo de pacientes, para ello recogimos los siguientes datos:
-
Edad (media de edad y rango de edad) y sexo.
-
Presencia/ausencia de factores de riesgo cardiovascular. Debiendo quedar definidos la presencia de ninguno, uno, dos y tres ó más, dentro de los cinco recogidos: hipertensión arterial (HTA), cardiopatía asociada (cptía), diabetes mellitus (DM), dislipemia (DL) y tabaquismo (tabq).
-
Puntuación en la prueba de screaning de deterioro cognitivo Mini-Mental State Examination (MMSE, Folstein 1975)13.
-
Localización de las lesiones hiperintensas, sugerentes de alteración vascular, tras la realización de resonancia magnética craneal (RM). Según el informe radiológico se determinaron los siguientes predominios regionales: sustancia blanca profunda, sustancia blanca profunda con afectación de los ganglios de la base y periventricular.
RESULTADOS
Los resultados obtenidos en nuestro estudio descriptivo evidenciaron los siguientes resultados:
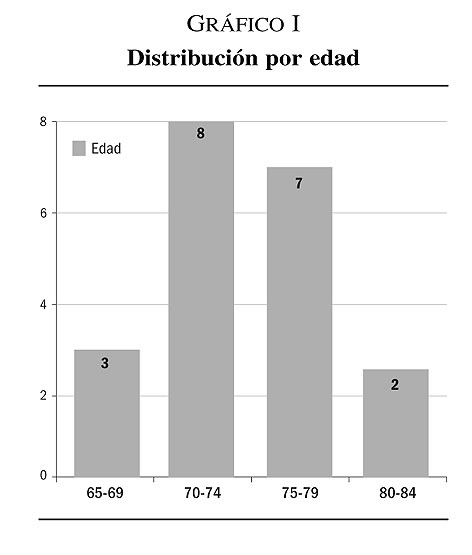
1. Los 20 pacientes seleccionados (N = 20) muestran una edad media de 74,2 años (X = 74,2), quedando establecido el rango de edad entre 67-83 años.
El 75% de nuestra muestra queda ubicada en la séptima década de la vida (70-79 años) (gráfico I).
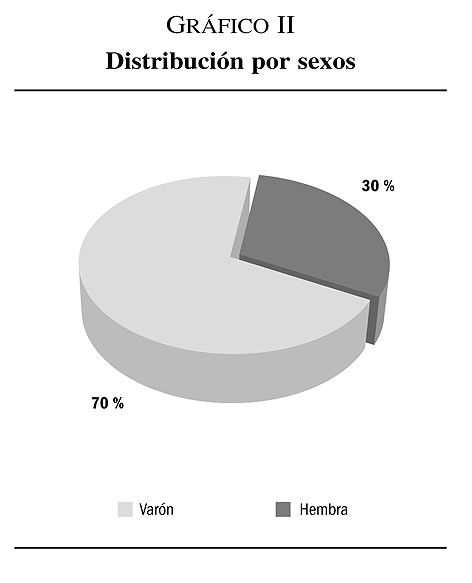
2. La distribución por sexos nos muestra la existencia de un predominio superior al triple por el sexo varón que por el sexo femenino: varón: 70% (n = 14) y femenino: 30% (n = 6) (gráfico II).
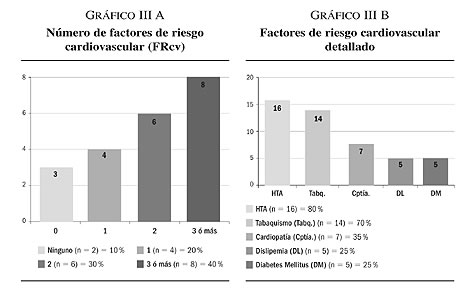
3. En cuanto a la presencia/ausencia de los factores de riesgo cardiovascular (FRcv), así como la prevalencia de los FRcv seleccionados (HTA; cptía; DM; DL; y tabq), los resultados obtenidos muestran que:
El 90% (n = 18) de nuestra muestra posee al menos un FRcv. Más detallado encontramos como el 40% (n = 8) tiene tres ó más FRcv; el 30% (n = 6) presenta dos FRcv asociados; el 20% (n = 4) únicamente posee un FRcv; y sólo el 10% (n = 2) carece de la existencia de FRcv asociado (gráfico III A).
El 80% (n = 16) de nuestra muestra padece HTA, siendo el FRcv más prevalente. El tabaquismo (Tabq) aparece recogido en segundo lugar, con un resultado del 70% (n = 14). Asimismo el resto de FRcv definidos quedan distribuidos de la siguiente forma: cardiopatía (Cptía) 35% (n = 7); diabetes mellitus (DM) 25% (n = 5); y dislipemia (DL) 25% (n = 5) (gráfico III B).
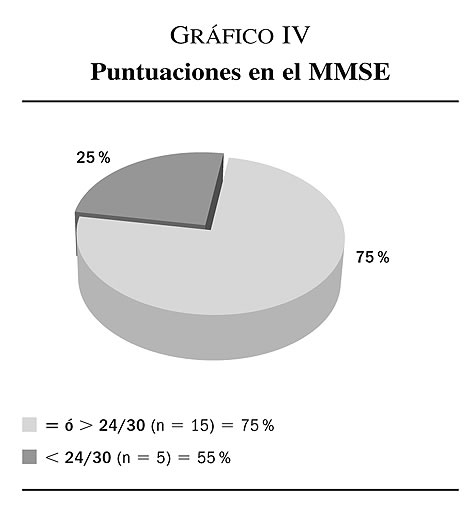
4. Los resultados obtenidos de la realización de la prueba de screening de deterioro cognitivo (MMSE), muestran como el 75% de los pacientes seleccionados presentan puntuaciones por encima del punto de corte, indicativas de funcionamiento cognitivo normal (MMSE = ó > 24/30: n = 15). El 25% restante de la población a estudio obtiene puntuaciones por debajo del punto de corte indicativas de posible deterioro cognitivo (MMSE < 24/30: n = 5) (gráfico IV).
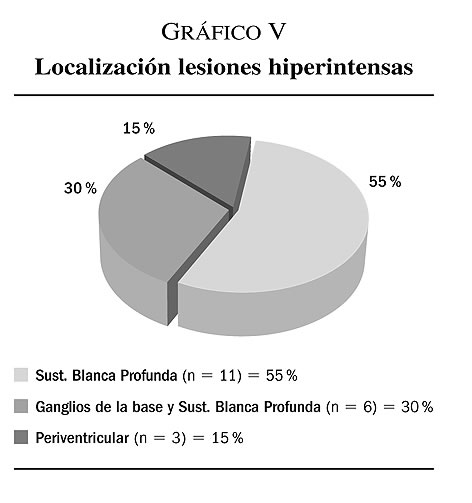
5. La realización de RM craneal en nuestra población mostró la presencia de las lesiones hiperintensas sugerentes de alteración vascular en la totalidad de los sujetos seleccionados. Los resultados obtenidos nos muestran como el 55% (n = 11) tienen localizadas las hiperintensidades en la sustancia blanca profunda, el 30% (n = 6) en la sustancia blanca profunda con afectación de los ganglios de la base y el 15% (n = 3) restante en la zona periventricular (gráfica V).
DISCUSIÓN
A pesar de la polémica suscitada en torno a la hipótesis de la depresión vascular entre los defensores de ésta2, 4, 14, 15, 16 y los detractores de la misma17, 18 según los datos que estemos manejando, en nuestro trabajo sobre la depresión de inicio tardío nos limitamos a realizar una descripción de las circunstancias que rodeaban a este tipo de pacientes.
Dadas las características clínicas que presentaban algunos de los pacientes con sintomatología depresiva que acudían a las consultas de psiquiatría de nuestro hospital, intentamos encontrar una explicación a la forma de presentarse este tipo de depresión (presencia de FRcv, la no existencia de historia depresiva previa, características de los síntomas afectivos, alteración cognitiva o lesiones específicas en las imágenes de RM).
La afectación fundamental que se produce en la depresión de inicio tardío con respecto a las funciones cognitivas es un deterioro de predominio frontal, es decir, con alteración de las funciones ejecutivas19, 20, alteración que no puede objetivarse mediante el MMSE. En esta alteración ejecutiva frontal, los parámetros a valorar serían la fluidez verbal, la atención-concentración, las actividades de planificación y el pensamiento abstracto. Olivera15 recomienda una exploración neuropsicológica que incluya: Trail Making Test A y B, Test de Stroop, Fluidez Verbal Categorial, Subtest de Dígitos de la WAIS y el Test de Wisconsin. En nuestra muestra, podemos observar como la mayoría de los pacientes puntuaban en el MMSE con cifras por encima del punto de corte (MMSE = ó > 24/30).
Por otro lado, existen divergencias entre los distintos autores en cuanto a la localización de las lesiones hiperintensas en RM que determinarían la aparición de depresión de inicio tardío. De esta manera Jorm y cols.21 observan que solamente las lesiones vasculares que aparecen en la sustancia blanca dan lugar a sintomatología depresiva. Por el contrario Steffens2, Greenwald11 y Baldwin12 afirman que las lesiones que justificarían este tipo de depresión se encuentran tanto en la sustancia blanca como en la sustancia gris. Asimismo, se ha comprobado que hay una mayor asociación a demencia cuando las hiperintensidades afectan a la sustancia blanca periventricular, de igual forma se ha podido apreciar que existe asociación con cuadros depresivos si las lesiones están localizadas en la sustancia blanca profunda3, 22. En nuestro estudio observamos que la sintomatología depresiva aparece en los pacientes cuyas lesiones se distribuyen por la sustancia blanca y la sustancia gris subcortical. La mayor parte de los pacientes tenían las señales hiperintensas localizadas a nivel de la sustancia blanca profunda.
CONCLUSIONES
El presente estudio descriptivo comporta una serie de limitaciones de las que no somos ajenos, siendo preciso realizar estudios más exhaustivos desde el punto de vista metodológico. A pesar de ello, puede inferirse las siguientes conclusiones:
1. En nuestro estudio, la mayoría de los pacientes con depresión de inicio tardío presentaban FRcv.
2. Dado que la alteración cognitiva que aparece en este tipo de depresión es de predominio frontal con afectación de las funciones ejecutivas, el MMSE no es recomendable como única prueba de screening.
3. Las señales hiperintensas en las imágenes de RM de nuestros pacientes se localizaban más frecuentemente a nivel de la sustancia blanca profunda.
BIBLIOGRAFÍA
1. Gilabert E, Guerrero A, Rojo JE. Depresión Vascular. Aula Médica Psiquiatría 2002; 4: 227-241.
2. Steffens DC, Ranga K. Structural Neuroimaging and mood Disorders: Recents Findings, Implications for Classification, and Future Directions. Society of Biological Psichiatry 1998.
3. Ranga K, Hays JC, Blazer DG. MRI-Defined Vascular Depression. Am J Psichiatry 1997; 154: 497-501.
4. Alexopoulos GS, Meyers SB, Young RC, Kakuma M, Silbersweig D Charlson M. Clinically Defined Vascular Depression. Am J. Psychiatry, 1997; 154: 562-565.
5. Gayoso Orol MJ. Epidemiología y clínica. En: Guía de la buena práctica Clínica en geriatría. Depresión y ansiedad. Sociedad española de Geriatría y Gerontología 2004; 13-32.
6. Lesser M, Hill-Gutiérrez E, Millar RL, Boone KB. Lateonset depression with white matter lesions. Psychosomaties 1993; 34: 364-367.
7. Cummings J. The neuropsychiatry of Alzheimer’s disease and related dementias. London: Martin Dunitz, 2003.
8. Alexander GE, DeLong MR, Strick PL. Parallel organisation of functionally segregated circuits linking basal ganglia and cortex. Annu Rev Neurosci 1986; 9:357-381.
9. Parker G. Classifying depression: should paradigms lost be regained? Am J Psychiatry. 2000; 157: 1195-1203.
10. Fujikama T, Yanai, Yamawaki S. Psychosocial stressors in patients with major depresión and silent cerebral infarction. Stroke. 1997; 28: 1123-1125.
11. Greenwald BS, Kramer-Ginsberg E, Krishnan KRR y cols. Neuroanatomic localization of magnetic resonance imaging signal hyperintensities in geriatric depression. Stroke 1998; 29: 613-617.
12. Baldwin RC, O’Brien J. Vascular basis of late-onset depressive disorder. British Journal of Psychiatry 2002; 180: 157-160.
13. Folstein MF, Folstein SE, Mc Hugo, PR. Mini-mental State a practical method for grading the cognitive state of patients for the clinician. Journal of Psychiatric research 1975; 12:189-98.
14. Agüera Ortiz LF. Caso clínico 1, depresión vascular. La opinión del psiquiatra: Casos Clínicos. SANED, 2005; 2: 3-5.
15. Olivera Pueyo FJ. Relación entre patología vascular y depresión: Desde el ACV a la depresión vascular. Resúmenes de ponencias. Rev. Psicogeriatría 2005; 5: 34-36.
16. Kales HC, Maixner, DF, MelloW AM. Enfemedad cerebrovascular y depresión en ancianos. Am J Geriatr Psychiatry 2005; 13: 88-98.
17. Prince MJ, Harwood RA, Blizard R et al. Social support déficits, loleniless and life events as risk factors for depression in old age. The Gospel Oak Project VI. Psychological Medicine 1997; 27: 323-332.
18. Stewart R, Prince M, Richards M, Brayne C, Mann A, Stroke, vascular risk factors and depression. British Journal of Psychiatric 2001; 178: 23-28.
19. Vataja R, Pohjas Vaara T, Mäntylä R et al. Síndrome de disfunción ejecutiva-depresión en pacientes con accidente cerebrovascular. Am J Geriatr Psychiatry 2005; 13:99-107.
20. Rapp MA, Dahlman K, Sano M et al. Diferencias neuropsicológicas entre la depresión mayor geriátrica de inicio tardío y la recurrente. Am J Psychiatry 2005; 162: 691-698.
21. Jorm AF, Anstey KJ, Christensen H et al. Hiperintensidades de IRM y síntomas depresivos en una muestra de individuos de 60 a 64 años de edad. Am J Psychiatry 2005; 162: 699-705.
22. O’Brien J, Desmond P, Ames D et al. A magnetic resonance imaging study of white matter lessions in depression and alzheimer’s disease. Am J Psychiatry 1996; 168: 447- 485.
* Trabajo premiado con el Primer premio correspondiente a la octava edición del Master y Diplomatura de Postgrado en Psicogeriatría.