Informaciones Psiquiátricas - Segundo trimestre 2006. Número 184
Estimulación cognitiva en demencias: eficacia o placebo
Joan Deus
Departamento de Psicología Clínica y de la Salud. Universidad Autónoma de Barcelona.
Institut d’Alta Tecnologia, Parc de Recerca Biomèdica de Barcelona.
Recepción: 08-03-06 / Aceptación: 03-04-06
RESUMEN
Introducción
En el mundo occidental, gracias al nivel y cualidad de vida, se ha posibilitado aumentar la longevidad de los individuos produciéndose una eclosión de los nuevos casos de demencia y, especialmente, de la enfermedad de Alzheimer. No obstante, en la actualidad, no se dispone de un tratamiento causal para esta enfermedad y todo enfoque terapéutico, farmacológico y/o cognitivo, persigue la prevención de su progresión.
Objetivo
Valorar si un programa de estimulación cognitiva integral, aplicado en un Hospital de Día Psicogeriátrico enlentece el proceso clínico-evolutivo del paciente con diagnóstico de demencia senil tipo Alzheimer (DSTA) de leve a moderada evolución.
Sujetos y Método
Se diseño un estudio prospectivo y observacional, con distribución aleatoria a los dos grupos en estudio, durante 12 meses de duración. La muestra estaba constituida por 62 pacientes (46 mujeres y 16 varones), 24 asignados al grupo tratado cognitivamente (22 mujeres y 2 varones) y 38 al grupo no tratado o control (24 mujeres y 14 varones).
Resultados
El grupo de pacientes con DSTA en tratamiento con estimulación cognitiva, según las puntuaciones directas obtenidas en el MEC, MMSE y ADAS, presenta estadísticamente un menor deterioro neuropsicológico a los doce meses de seguimiento cognitivo (z = -2,,07; P = 0,036; z = -2,03; P = 0,046; y z = -2,11; P = 0,036 respectivamente) respecto a un grupo de pacientes con el mismo grado de evolución que no ha recibido dicha intervención terapéutica.
Conclusiones
Los resultados preliminares confirman, provisionalmente, que una intervención no farmacológica mediante un programa de estimulación cognitiva integral parecen enlentecer, o mejorar cognitivamente a largo plazo, el curso evolutivo de la enfermedad de Alzheimer.
Agradecimientos
A la Fundació «La Caixa» que ha financiado el proyecto de estudio de la eficacia de un programa de estimulación cognitiva integral en un Hospital de Día Psicogeriátrico. Con todo cariño a todos los profesionales que constituyen y han formado parte de la Unidad de Demencias y del Hospital de Día Psicogeriátrico de l’Antic Hospital de Sant Jaume i Santa Magdalena de Mataró del Consorci Hospitalari del Maresme.
INTRODUCCIÓN: DELIMITACIÓN CONCEPTUAL
El interés, conceptualización y preocupación por el deterioro cognitivo no son exclusivas de nuestra época, ya estaban presentes en las más antiguas culturas de la humanidad. Así, en la cultura romana se empezó a utilizar el término ‘demencia’ para describir cualquier estado de deterioro cognoscitivo o del comportamiento. La propia palabra demencia, derivada del latín demens/dementatus (que significa ‘de’ —privativo o fuera de—, ‘mens’ —inteligencia o mente— y ‘ia’ —estado de—), se encuentra inscrita en el poema De rerum natura de Tito Lucrecio (siglo I a. de C.). Sin embargo, y probablemente, fue Celso en el siglo I antes de Cristo quien incluyó por primera vez en su enciclopedia el término demencia como concepto del ámbito médico. En consecuencia, y curiosamente, la pérdida de memoria como deterioro cognitivo en el envejecimiento normal, ya referido por Cicerón (106-43 a. de C.) en su ensayo De senectute, se consideró como una enfermedad cerebral (o demencia) del envejecimiento1-2.
A lo largo de los siglos, no obstante, el término demencia se ha ido redefiniendo y diferenciándolo del concepto de senectud o envejecimiento normal y de la locura. Actualmente, el término demencia aún queda delimitado por los reformulados criterios clínico-descriptivo, evolutivo y anatómico-patológico3. Se define como un síndrome clínico adquirido por una causa orgánica, que hace referencia a un deterioro de las funciones cognitivas, respecto al nivel premórbido, progresivo o no progresivo, de lenta instauración y persistente4-6, sin alteración del nivel de conciencia, irreversible y con tratamiento paliativo o reversible y, frecuentemente, acompañado de otras manifestacio-nes psicopatológicas o conductuales, que afecta al normal funcionamiento social y ocupacional del individuo7-8. Dicho deterioro puede tener un inicio focal, con un curso clínico progresivo, afectando a una única función cognitiva y/o conductual, o bien alterar a diversas capacidades cognoscitivas, deterioro cognitivo difuso3.
Sin duda alguna, la enfermedad de Alzheimer (EA), cuya descripción anatomo-clínica se debe a Alois Alzheimer en 19079, se ha convertido en el prototipo y arquetipo histórico y semiológico de las demencias2. Actualmente, se la considera como la primera causa de demencia en la tercera edad10, con un incremento de su prevalencia a medida que envejece la población llegando del 15 al 20% de los sujetos con 80 años y siendo responsable de entre un 50 y un 70% del total de casos como forma senil11. El trastorno puede iniciarse bien antes de los 65 años como forma presenil12, aunque raramente en la cuarta década de la vida, bien después de los 65 años como forma senil4, 13. Actualmente, siguiendo los criterios de Katzman y colaboradores (1978)14, se considera que la forma presenil y senil son la misma entidad nosológica y patológica si bien con un curso evolutivo más rápido en la forma presenil3, 15. El diagnóstico clínico de posible o probable EA se realiza por exclusión de otras patologías neurológicas utilizándose los criterios establecidos en el DSM-IV-TR16, IDC-1017 y NINCDS-ADRDA18.
La EA se puede definir como un trastorno multisistémico degenerativo del sistema nervioso central, clínicamente caracterizado por un inicio insidioso con un deterioro cognitivo difuso y funcional progresivo, con la aparición, en el trascurso de la enfermedad, de alteraciones de la conducta, del estado de ánimo y alteraciones psicóticas3. El eje central clínico y evolutivo de la EA está constituido por los trastornos neuropsicológicos, desde su inicio hasta su desenlace final19-20, si bien no siempre se manifiestan de forma homogénea21, siendo el deterioro progresivo de la memoria declarativa el componente cognitivo más prominente de la clínica neuropsicológica3-4, 20, con relativa preservación de la memoria implícita3, 22-23. Los signos neurológicos suelen aparecer cuando la demencia es de moderada a grave, si bien los síntomas no cognitivos pueden estar presentes desde el inicio de la enfermedad. La afectación neuropsicológica se pone de manifiesto con el clásico síndrome afaso-apraxo-agnósico, conjuntamente con una alteración de la memoria declarativa o explícita, de las funciones ejecutivas y cambios psicopatológicos que definen un patrón de afectación neocortical difusa, de predominio biparieto-temporal, y límbica3, 24-25.
Sin embargo, el interés terapéutico de la demencia, y en especial de la EA, no es evidente hasta la segunda mitad del siglo xx cuando los síndromes neurodegenerativos se configuran como uno de los problemas sanitarios y sociales más graves26. Dado que en el mundo occidental, gracias al nivel y calidad de vida, se ha posibilitado aumentar la longevidad de los individuos, se ha producido una eclosión de los problemas crónicos de salud27-28 y, entre ellos, de los nuevos casos de demencia senil tipo Alzheimer (DSTA) y otras demencias. Ello motiva la necesidad y la preocupación de asignar nuevos y mayores recursos sanitarios en el tratamiento de las enfermedades de la vejez y, en especial, de las demencias, tanto desde la vertiente farmacológica como desde la cognitiva y psicosocial27. Ello se debe a que el tratamiento de la demencia continúa siendo una asignatura pendiente, puesto que aún se desconoce el remedio eficaz para curar y ni siquiera detener o enlentecer el deterioro cognoscitivo de las enfermedades neurodegenerativas29.
Desde los años cincuenta han aparecido numerosas propuestas prospectivas de intervención terapéutica, fundamentalmente, desde la vertiente farmacológica y con dos finalidades básicas30. Una primera aproximación se enfoca hacia el tratamiento de los síntomas primarios y/o secundarios de la EA sin una influencia directa sobre el proceso neurodegenerativo. Este enfoque terapéutico ha sido, hasta hace poco, la única forma de intervención y se ha dirigido, básicamente, a corregir las alteraciones del comportamiento31. La segunda aproximación terapéutica, aparecida en los últimos años, se enfoca hacia el intento de enlentecer la progresión de la enfermedad o demorar su inicio30 con el uso de fármacos inhibidores de la acetílcolinesterasa28, 32-38. No obstante, en esta segunda propuesta también debe enmarcarse la estimulación cognitiva, como complemento y paralelamente al uso de la farmacoterapia en la EA19-20, 39, puesto que las intervenciones farmacológicas han mostrado, hasta el momento, limitaciones clínicas y poca eficacia terapéutica en el ámbito cognitivo27, 29, 40 y han resultado ser por sí solas insuficientes39.
Ciertamente, en la actualidad, no se dispone de un tratamiento causal para esta enfermedad y todo enfoque terapéutico va encaminado a la prevención de la progresión de la enfermedad28. La aplicación de terapias no farmacológicas en el tratamiento cognoscitivo y conductual de la EA, y de las demencias en general, se fundamenta en que, aunque no exenta de polémica26, 41-42, algunos trabajos han mostrado que ancianos con diagnóstico de DSTA mejoran cognitiva y funcionalmente de forma significativa tras un tratamiento cognoscitivo29, 43-53. Ello sugiere la posibilidad de defender la neuroplasticidad cognitiva o el potencial de aprendizaje de los pacientes afectos de un proceso degenerativo54-55.
En suma, la intervención en las demencias ha de tener en cuenta dos componentes. El primero, la etiología neurobiológica de las demencias sobre la que actuarán los fármacos y, en particular, los anticolinesterásicos. El segundo, el aislamiento cognitivo y sensorial que acompaña a las demencias y agrava su manifiesto deterioro cognoscitivo y conductual56, sobre el que actuará la estimulación cognitiva. En consecuencia, se postula que se precisa de una combinación de tratamientos farmacológicos y cognitivos (estimulación cognitiva, psicoestimulación o intervención cognitivo-conductual) como abordaje terapéutico de las demencias. Dicha intervención ha sido denominada terapia combinada y ya ha demostrado su eficacia frente a los tratamientos farmacológicos aislados y frente al placebo en pacientes con EA39, 57.
FUNDAMENTACIÓN NEUROPSICOLÓGICA Y NEUROBIOLÓGICA DE LOS TRATAMIENTOS NO FARMACOLÓGICOS EN LAS DEMENCIAS
La intervención no farmacológica o la rehabilitación e intervención cognitivo-conductual tiene, sin lugar a dudas, un importante papel en el tratamiento de la Enfermedad de Alzheimer (EA) y en las demencias58. «Los objetivos de la rehabilitación cognitiva y conductual son mejorar la capacidad de las personas para procesar e interpretar la información dotándolas de una mejor aptitud para funcionar en la vida familiar y comunitaria. El entrenamiento rehabilitador se centra en mejorar la función cognitiva específica»59. Dicha intervención terapéutica actúa sobre las capacidades cognitivas que muestran una alteración clínicamente significativa39 y se fundamentan esencialmente en seis preceptos: las terapias blandas, la psicoestimulación o estimulación cognitiva, la reserva cerebral, dependencia de uso, la neuroplasticidad y la redundancia.
En primer lugar, el término de ‘terapias blandas’ hace referencia al conjunto de estrategias terapéuticas dirigidas a los aspectos bio-psico-sociales del paciente con EA, u otro diagnóstico de demencia, con fines rehabilitadores de las capacidades cognitivas afectadas y modificadoras de la conducta60. Incluye además un conjunto de actividades grupales y/o individuales para la estimulación de las funciones cogniti-vas residuales con ejercicios estrictamente adecuados al grado de deterioro cognoscitivo y a la tipología conductual del paciente. Asimismo, y teniendo en cuenta los modelos psicosociales, se persigue el apoyo a los problemas mentales, afectivos y de la conducta que acontecen durante el proceso de adaptación a las consecuencias del progresivo deterioro cognitivo57. Así, las terapias blandas mantienen un enfoque esencialmente individual o dirigido a cada paciente, pone un especial énfasis en la validación del propio enfermo al maximizar sus capacidades residuales y minimizar los déficit, y se caracteriza por un enfoque multidimensional de los posibles problemas conductuales o no cognitivos del paciente61.
En segundo lugar, la ‘psicoestimulación’ o ‘estimulación cognitiva’ se define como un conjunto de estímulos generados por la neuropsicología terapéutica o intervencionista con el fin de una rehabilitación62. Sin embargo, si bien la rehabilitación pretende restaurar o recuperar en mayor o menor medida una función/nes cognitiva/s específica/s alterada/s, la psicoestimulación únicamente persigue maximizar las funciones cognoscitivas preservadas para mantener la necesidad de dependencia al mínimo posible. La estimulación cognitiva pretende realizar tareas tendentes a activar y mantener las capacidades mentales utilizando un conjunto de técnicas que incluyen actividades de estimulación de la memoria, la comunicación verbal, el reconocimiento, el ritmo y la coordinación y el esquema corporal63. Se trata de una estimulación personalizada y, por tanto, básicamente adaptada a las capacidades cognitivas residuales del paciente, posibilitando así su utilización y el despertar de los olvidos cognitivos por la falta de su uso o abandono30, 64. De ello se deduce la necesidad, como punto de partida, de una exploración neuropsicológica exhaustiva que posibilitará la programación terapéutica a desarrollar fundamentada en la diferenciación específica e individualizada de cada paciente26, 64. El tratamiento con psicoestimulación pretende favorecer la potencial capacidad de reorganización funcional del demente por la presentación de estímulos generados por la neuropsicología intervencionista que elicitan respuestas cognitivas y emocionales como resultado del uso de las capacidades neuropsicológicas residuales, objetivadas tras la exploración neuropsicológica, con el fin de enlentecer el curso de la enfermedad65 y no con la finalidad de alcanzar el óptimo funcionamiento premórbido64.
En tercer lugar, otro precepto importante es el término de ‘reserva cerebral’66 que puede activarse mediante el aprendizaje, el ejercicio o el entrenamiento mental67. Dicho término permite explicar, muchas veces, los hallazgos clínico-neuropatológicos que se constatan en pacientes que no han estado en vida clínicamente demenciados, pero que en el estudio postmortem sí cumplen los criterios neuropatológicos de una demencia senil tipo Alzheimer68. Se presupone que estos pacientes presentan una cierta reserva cerebral, bien por la disposición de sus estrategias cognitivas para la resolución de problemas bien por un mayor número de neuronas o de densidad en sus conexiones neurales bien por la cantidad de tejido cerebral funcional que mantiene la persona, que le posibilita mantener una mejor y mayor preservación de las capacidades cognoscitivas68. Diversos autores afirman que esta reserva cerebral reduce la expresión clínica de la EA y fundamenta el hecho de que pueda incidirse en ella mediante la estimulación cognitiva60.
En cuarto lugar, se reconoce que a lo largo de la vida de todo ser humano existe una capacidad de aprendizaje, más o menos limitada, que se pone de manifiesto en los posibles cambios de conducta, en la adecuación a nuevos estímulos y ambientes, en la mejora de las habilidades instrumentales y en la adquisición de nuevas estrategias y esquemas cognitivos. Dicha capacidad de reserva o almacenaje cognoscitivo se basa en la plasticidad adaptativa que posee el cerebro, es decir, que el encéfalo tiende a modificarse estructural y funcionalmente mientras aprende o reaprende. Sin embargo, bien la posterior recuperación de un material aprendido bien la máxima eficacia de una capacidad cognitiva depende de su grado de utilización. Basándose en dichas premisas Mahieux y Gely-Naergeot (1997)69 postularon el concepto de ‘dependencia de uso’. Así, dicho término postula que las únicas sinapsis neuronales que persisten en el tiempo son las que se activan de forma regular al elicitarse reiterativamente una respuesta cognitiva o emocional, mientras que aquellas sinapsis que no son utilizadas se degeneran por falta de uso y, en consecuencia, son eliminadas. Por tanto, bajo dicho supuesto, cabe esperar que la estimulación de las funciones cognitivas residuales en el paciente con demencia retrase su degeneración por el uso de los circuitos neuronales implicados.
En quinto lugar, por ‘neuroplasticidad’ se entiende la respuesta del cerebro para adaptarse a nuevas situaciones y la capacidad para poder reestablecer el equilibrio alterado después de una lesión cerebral70. La plasticidad cerebral puede considerarse como una flexibilidad morfológica del sistema nervioso que permite algunos cambios neurales, nuevas sinaptogénesis o regeneración de las neuronas lesionadas o remodelación de la morfología y función de las células gliales71-73, que posibilitan tejer el nuevo tapiz celular del que va a depender la capacidad del paciente para mantener o preservar una función cognoscitiva o recuperar un déficit cognitivo. Dicho fenómeno permite defender que el cerebro lesionado continúa teniendo una potencial capacidad de aprendizaje o de reaprendizaje, después de una lesión cerebral. Sin embargo, el concepto de neuroplasticidad no se desarrolló hasta la década de los años 80, describiendo el cerebro como un órgano dinámico y que puede cambiar constantemente su arquitectura y sus relaciones funcionales como respuesta adaptativa. Parece evidente que la plasticidad cerebral se traduce como el intento del sistema nervioso central de poder reestructurar las funciones cerebrales o, como mínimo, compensar el daño producido por la enfermedad74. No obstante, la capacidad de reorganización funcional cerebral se ha adjudicado básicamente a los pacientes con lesiones cerebrales congénitas o adquiridas, cuestionándose la plasticidad cerebral en ancianos y en pacientes dementes. Recientes investigaciones, sin embargo, han puesto de manifiesto que existe la neuroplasticidad en el anciano, incluso en el paciente demente, si bien en menor intensidad74-75. Parece razonable y evidente, por otra parte, que en las fases de mayor deterioro cognitivo, la capacidad de plasticidad cerebral sea mínima o nula debido a la gran pérdida de masa neuronal, desarborización sináptica y bloqueo de neurotransmisores76.
Finalmente, y no por ser el más antiguo, no hay que olvidar ni desmerecer el término de ‘redundancia’ propuesto por Luria (1976)77. Éste postula que una misma función cognitiva, en la medida en que no es unitaria y que está configurada por diferentes módulos, puede llegar a ser ejecutada por diversos subsistemas cerebrales distintos, siendo preponderante uno de ellos para el control de una función neuropsicológica. Sin embargo, cuando se produce una lesión cerebral y, en consecuencia, un déficit cognitivo, éste podría compensarse, bien tras la recuperación espontánea bien tras la rehabilitación o estimulación cognitiva, por la activación de otro/s subsistema/s córtico-corticales o córtico-subcorticales conservado/s o no dañado/s que podrían sustituir a las estructuras cerebrales lesionadas y ejercer un control sobre la función neuropsicológica para su preservación o recuperación.
CONCEPTO Y OBJETIVOS DE LA INTERVENCIÓN COGNITIVO-CONDUCTUAL EN LAS DEMENCIAS
Se han propuesto diversos términos, en la literatura científica, para referirse a la intervención no farmacológica en las demencias. Todos ellos han sido ampliamente aceptados, cada uno posee unas características definitorias propias y, de hecho, comparten objetivos terapéuticos en los procesos neurodegenerativos. En el presente trabajo se propone y delimita, sin embargo, un nuevo vocablo con la pretensión de que haga referencia a una intervención específica en el ámbito de la salud, más integradora de las áreas objeto de tratamiento y de intervención multidisciplinar en las demencias. Así, desde el ámbito neuropsicológico se propone el término de intervención cognitivo-conductual en las demencias, que al igual que el concepto de terapias blandas60, hace referencia al conjunto de estrategias terapéuticas dirigidas a los aspectos bio-psico-sociales del paciente con demencia (ver esquema 1). Específicamente, y en primer lugar, por ‘intervención’ se entiende al conjunto de actividades o actos encaminados a introducir cambios en un proceso en curso. En segundo lugar, la ‘cognición’ hace referencia a las funciones neuropsicológicas o cognoscitivas, es decir, a los procesos mentales complejos encargados del procesamiento de la información. En tercer lugar, el término ‘conducta’ puede definirse como las acciones que un organismo/s o sujeto/s pone/n de manifiesto en relación con su entorno social o mundo de estímulos. Finalmente, y en cuarto lugar, la locución ‘demencia’ delimita a qué tipo de pacientes va dirigida la intervención, es decir, aquellos enfermos con un síndrome clínico adquirido caracterizado por el deterioro progresivo de las funciones cognitivas y la alteración del comportamiento que conlleva una pérdida de la autonomía funcional y un deterioro de su entorno social más inmediato.
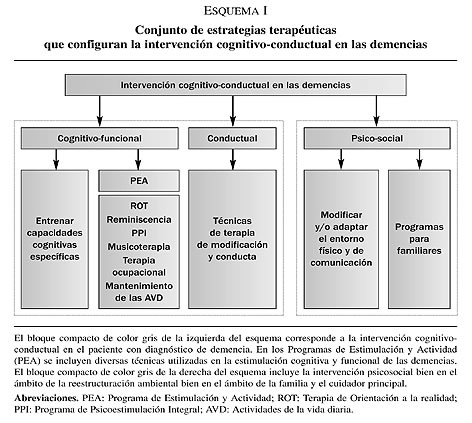
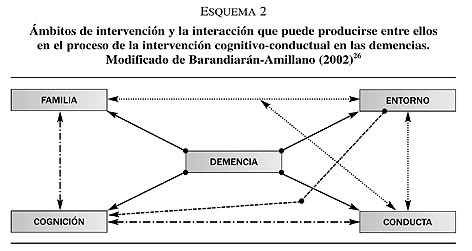
La intervención cognitivo-conductual en las demencias se rige bajo tres principios. En primer lugar, el concepto de intervención puesto que en la actualidad se considera que en las enfermedades neurodegenerativas la intervención no es exclusiva del ámbito cognitivo sino que abarca varios contextos de la vida del paciente y de su entorno más inmediato. En segundo lugar, el de la estimulación cognitiva. Así, tal y como se ha especificado con anterioridad, no se persigue alcanzar el óptimo funcionamiento premórbido del paciente, sino el de mantener las funciones cognitivas residuales y enlentecer el declive neuropsicológico. En tercer lugar, se asume que todo proceso neurodegenerativo se caracteriza no sólo por la presencia de un deterioro cognitivo sino también conductual y que ambos interfieren en la vida familiar, social y laboral del paciente41-42. En consecuencia, no tan sólo la intervención debe de enfocarse en la maximización de las funciones cognitivas preservadas sino en la modificación de los patrones de conducta del paciente, del entorno socio-ambiental más inmediato y familiar que pueden agravar el estado cognitivo y conductual del enfermo y la convivencia de su entorno (ver esquema 2).
Así pues, la intervención cognitivo-conductual en las demencias puede definirse como al conjunto de actividades programadas, métodos y estrategias cognitivas y conductuales que pretenden optimizar o maximizar la eficacia de las funciones cognoscitivas preservadas y reducir los problemas conductuales del paciente para mantener la necesidad de dependencia en su mínima expresión, modificar o reestructurar su entorno socio-ambiental más inmediato y proporcionar soporte psicológico a los cuidadores principales. En consecuencia, y más específicamente, los objetivos que persigue la intervención cognitivo-conductual en las demencias son:
1. Estimular cognitivamente al paciente para mantener sus capacidades cognoscitivas residuales y enlentecer el curso del progresivo deterioro.
2. Mejorar, en la medida de lo posible, el rendimiento cognitivo y funcional del paciente.
3. Evitar la desconexión del paciente con su entorno y fortalecer las relaciones sociales.
4. Proporcionar al paciente una sensación de seguridad e incrementar su autonomía personal en las actividades, básicas e instrumentales, de la vida diaria.
5. Estimular la propia identidad y autoestima: dignificar al paciente.
6. Modificar y reducir los cambios de comportamiento que experimentan los enfermos con demencia.
7. Modificar el entorno físico habitual del enfermo para disminuir conductas inadecuadas y aumentar o mantener la autonomía funcional.
8. Minimizar el estrés y evitar reacciones psicológicas anómalas del cuidador principal.
9. Mejorar la calidad de vida del paciente y del/los cuidador/es.
Finalmente, dicha intervención no farmacológica debe fundamentarse y cumplir cinco importantes condiciones. En primer término, hay que remarcar que toda intervención cognitivo-conductual en las demencias debe basarse en una exploración neuropsicológica exhaustiva que permita delimitar el patrón de deterioro cognitivo manifiesto y qué capacidades cognoscitivas restan preservadas para poder elaborar un programa personalizado de estimulación cognitiva26, 39, 60, 63. En segundo lugar, no es infrecuente que los pacientes con un proceso neurodegenerativo manifiesten, en el curso de su evolución, síntomas no cognitivos o síntomas psiquiátricos y conductuales en las demencias que pueden agravar el deterioro cognitivo del paciente y que, además, son la principal causa de sobrecarga y estrés en el cuidador principal. En consecuencia, la exploración neuropsiquiátrica debe ser uno de los objetivos de una evaluación integral que permita delimitar dicha sintomatología para poder programar o instaurar el tratamiento conductual más idóneo u otras estrategias de intervención farmacológicas y no farmacológicas78.
En tercer lugar, es conocido que como consecuencia de un proceso degenerativo se produce en el paciente, en conjunto, una pérdida de la adaptabilidad al medio y un enlentecimiento general de cualquier forma de actividad física. Ello conlleva, por tanto, la necesidad de efectuar una valoración funcional entendida como la evaluación de las funciones físicas que realiza el paciente y la capacidad para realizar ciertas actividades de la vida diaria79. En cuarto lugar, es importante objetivar el impacto que los trastornos cognitivos y conductuales del paciente con demencia producen sobre los cuidadores principales y el entorno familiar. Así, se debe incluir una evaluación de la posible sobrecarga del cuidador principal78. Por último, todo proceso de evaluación del paciente con demencia y de la sobrecarga en el cuidador debe desarrollarse de forma continua, revisándose periódicamente, para poder adaptarlos a las nuevas circunstancias que vayan surgiendo en el proceso de la enfermedad26.
DESCRIPCIÓN DE LA INTERVENCIÓN COGNITIVO-CONDUCTUAL EN LAS DEMENCIAS. TÉCNICAS O PROGRAMAS DE INTERVENCIÓN DE LA ESTIMULACIÓN COGNITIVA O PSICOESTIMULACIÓN
Hasta la actualidad la intervención en el ámbito cognitivo ha constituido el objetivo fundamental de las terapias no farmacológicas en las demencias. Dicha intervención está formada por una serie de actividades neurofuncionales adaptadas al enfermo que inciden de forma reiterativa y plurimodal en las capacidades cognitivas residuales, con el objetivo de incrementar o mantener el rendimiento cognitivo y funcional del paciente41-42. Hasta la fecha dichas intervenciones reeducativas han estado fundamentalmente dominadas por la terapia de orientación a la realidad79 y la terapia de la reminiscencia80, si bien con posterioridad y de forma progresiva se han ido proponiendo otros programas de estimulación cognitiva.
La terapia de orientación a la realidad (ROT)43, 46, 50, 79
Es un método de intervención no farmacológico cuyo objetivo es el tratamiento de las alteraciones de la orientación facilitando y estimulando la reorientación témporoespacial y autopsíquica mediante preguntas directas y la presentación continua de informaciones de orientación sobre sí mismo y su entorno (tabla I). Ello permite que el paciente no se desconecte de su entorno personal más inmediato y se incrementa su autonomía. La ROT utiliza elementos como la reminiscencia o la adaptación del entorno63. Es una de las técnicas más ampliamente utilizadas en el tratamiento de los pacientes con demencia y se ha demostrado discretas progresiones en la capacidad del paciente para orientarse, si bien no se constata mucha generalización a otros dominios de la cognición.

La reminiscencia43, 80
Dicha terapia cognitiva se caracteriza por elicitar el recuerdo sistemático de memorias antiguas (autobiográfica y remota o retrógrada), es decir, llevar a la consciencia la historia personal del paciente a través de los recuerdos personales (tabla II). La reminiscencia constituye una forma de activar el pasado personal del paciente mediante la presentación de estímulos facilitadores tales como objetos, canciones, fotografías o películas. Se interviene recordando los aspectos sucedidos en el pasado personal, partiendo del supuesto, ya ampliamente consensuado, de que los recuerdos antiguos y remotos se encuentran relativamente preservados26. Así pues, se trata de centrar el recuerdo en los aspectos personales de los acontecimientos vividos más que en la perfección del recuerdo y de su correcta localización episódica41, 63.

Entrenamiento de las capacidades cognitivas específicas
La terapia cognitiva específica implica un conjunto de técnicas de la neuropsicología cognitiva rehabilitadora e intervencionista en las que el paciente es sometido, en base al entrenamiento y la reeducación, a una serie ejercicios terapéuticos dirigidos a recuperar aspectos concretos de las capacidades cognitivas deterioradas (tabla III). Según Beck y colaboradores (1988), el entrenamiento en la recuperación de las habilidades cognitivas es una de las intervenciones destinadas a proveer el condicionamiento cognitivo que permita el mantenimiento de las habilidades funcionales y cognitivas de las personas con demencia al actuar sobre los trastornos perceptivos, mnésicos y del lenguaje84. Basándose en dicha filosofía diversos autores han elaborado y desarrollado diferentes programas para el entrenamiento o estimulación y rehabilitación de funciones cognitivas específicas, tales como la atención85, la memoria declarativa47, 86-89, la memoria procedural48 o las funciones ejecutivas90.

La musicoterapia91-92
Puede definirse como la utilización de la música para conseguir el reestablecimiento, mejora o mantenimiento de la salud física o psíquica de los individuos93. Es la aplicación sistemática de la música como recurso terapéutico para estimular la psicomotricidad, la comunicación y la expresión de emociones de los pacientes con demencia, potenciando las capacidades rítmicas, auditivas y de coordinación26, 42. Desde la década de los 80 del siglo xx se ha ido presentando la musicoterapia como un tratamiento recomendado para las personas que sufren Alzheimer y otros tipos de procesos neurodegenerativos, ayudándolas a mantener las capacidades cognitivas y funcionales preservadas y mejorando su calidad de vida42 (tabla IV).

La psicomotricidad
La terapia psicomotriz se define como un procedimiento terapéutico que tiende a favorecer el dominio del propio cuerpo, la relación y comunicación con uno mismo y con los demás objetos y personas del espacio que lo rodea41. La psicomotricidad intenta estimular al máximo la motricidad voluntaria y automática, la coordinación, la orientación y las funciones visoespaciales a través del movimiento como elemento terapéutico78. Sus objetivos son el incrementar la fuerza muscular, conservar la movilidad, el mantenimiento del esquema corporal y la coordinación motora, reconocimiento del espacio intra y extrapersonal, la mejora de la resistencia a la fatiga y ayudar a conseguir una mayor autonomía funcional en las actividades de la vida diaria78, 41, 61.
Programa de psicoestimulación integral (PPI)29, 57, 60, 78
El PPI es una estrategia terapéutica globalizadora u holística fundamentada en la neuroplasticidad cerebral y basada en la neuropsicología cognitiva, la terapia de modificación de conducta y el estado biopsicosocial del paciente con demencia, con el fin de mejorar o enlentecer el proceso clínico evolutivo a corto y medio plazo (tabla V).

El modelo teórico en el que se sustenta la PPI es el denominado retrogénesis82, en el que se postula que la persona con EA sigue un patrón involutivo inverso al desarrollo de la inteligencia propuesta por Jean Piaget83. Las técnicas que emplea la PII son variadas y van desde la estimulación cognitiva a la cinesiterapia, la psicoexpresión, la musicoterapia, la relajación, de las actividades ocupacionales al mantenimiento de las actividades de la vida diaria (AVD), haciendo uso parcial de la terapia de validación, la de remotivación o la de reminiscencia, facilitando la resocialización y la participación del enfermo en las tareas grupales60. Los enfermos participan ocho horas al día en este programa y acuden durante cinco días a la semana29, 78. El conjunto de estrategias e intervenciones, tanto los dirigidos al paciente como al cuidador principal, es el que define su carácter global60. Los resultados obtenidos por este programa muestran una mejora en el rendimiento cognitivo a medio plazo (seis meses) de la intervención y una preservación del estado cognoscitivo a largo plazo (a los doce meses del tratamiento no farmacológico)29, 78.
Programas de intervención en la capacidad funcional
Mantener o readaptar las capacidades que los enfermos con demencia tienen para funcionar con autonomía en la vida diaria contribuye a reafirmar su autoestima y los lazos que los unen con su entorno. A medida que la enfermedad neurodegenerativa avanza, el paciente precisa cada vez una mayor estimulación funcional puesto que es este ámbito el que le proporciona autonomía41.
La terapia ocupacional
La intervención se lleva a cabo mediante la utilización de numerosas técnicas de tratamiento para los déficit funcionales que acompañan a las demencias, adaptándose en todo momento al nivel cognitivo del paciente60. Trata a la persona que presenta una disfunción ocupacional, con la finalidad de conseguir la máxima autonomía posible en las actividades de la vida diaria (AVD) y en su entorno, utilizando la ocupación como medio terapéutico94. Se entiende por ocupación cualquier actividad significativa para la persona dentro de los ambientes en los cuales vive y funciona. Las actividades se analizan con el fin de ajustarlas a las capacidades de la persona dentro de su vida diaria, de sus intereses y de sus interacciones sociales95.
Mantenimiento de las actividades significativas de la vida diaria
La repetición de ciertas tareas o actividades significativas de la vida diaria (por ejemplo vestirse, poner la mesa o preparar la comedia) se considera un método de rehabilitación y de readaptación del enfermo que permite y facilita el mantenimiento y la aparición de capacidades cognitivas que habían estado bien perdidas, bien olvidadas por el desuso42, 60, 63.
Técnicas de modificación de conducta
Los trastornos psicológicos y del comportamiento en los pacientes con demencia constituyen una de las consecuencias más discapacitantes de las demencias y son una de las causas principales de la sobrecarga del cuidador principal78. En consecuencia, la prevención, el control y el tratamiento de los trastornos psicológicos y del comportamiento tendrá un impacto fundamental en el rendimiento cognitivo y funcional del paciente, reflejándose todo ello en la calidad de vida global de la familia63. Se ha sugerido que la intervención conductual parece ser un abordaje terapéutico útil para controlar y mitigar los cambios de conducta que experimentan los pacientes con demencia (tabla VI).

Es una de las técnicas desarrolladas para el control de los trastornos del comportamiento. Dicha intervención se fundamenta en el paradigma de la psicología del aprendizaje que considera que una conducta y/o problema puede ser modificable a través de técnicas específicas (control de estímulos, refuerzo, extinción, modificación del entorno o distracción) que pretenden sustituir una conducta por otra más adaptativa26, 42, 96. No obstante, el deterioro cognitivo que presentan los pacientes con demencia sugiere que no siempre se puedan cumplir los propósitos de la terapia de modificación de conducta. De hecho, una revisión de la literatura sugiere que una aproximación conductual como tratamiento de los problemas psicológicos y comportamentales del paciente con demencia puede tener éxito en la modificación de una conducta específica y definida del paciente. Sin embargo, puede tener un escaso éxito en la generalización y el mantenimiento a largo plazo de la conducta deseada42, 96.
Programas de adaptación cognitiva y funcional del entorno o de reestructuración ambiental
El objetivo principal de estos programas es la modificación del entorno físico habitual del paciente con demencia, en la medida en que le pueda servir de apoyo para elicitar respuestas cognitivas y funcionales más efectivas y disminuir comportamientos inapropiados26.
Adaptación cognitiva y funcional del entorno físico
Actualmente, nadie cuestiona que el entorno físico, familiar o no familiar, del paciente con demencia y de su dominio es sumamente importante. En consecuencia, la intervención no debe ir únicamente encaminada a la persona con déficit cognitivo, sino que debería también centrarse en su medio externo. Se debe, pues, plantear una intervención desde el entorno, puesto que son espacios de relación interpersonal y de comunicación42. Con la adaptación cognitiva y funcional del entorno físico se pretende compensar y facilitar los rendimientos del paciente para que presente un menor trastorno funcional63. Las modificaciones del entorno o ambiente del paciente se deben realizar siguiendo los principios de seguridad, prevención y simplificación, con objeto de minimizar los requerimientos mnésicos y cognitivos del enfermo26, 63.
Técnicas de comunicación
Establecen cuáles deben ser las actitudes y cómo debe interactuar el cuidador con el paciente. Estas técnicas se basan en los principios de la simplificación de los mensajes orales y de la combinación de informaciones verbales con la comunicación no verbal, la regulación de las distancias y las posiciones entre el cuidador y el paciente con demencia63.
Técnicas de validación97-99
Es una terapia de comunicación, constituida por 14 técnicas, con personas diagnosticadas de enfermedad de Alzheimer y demencias relacionadas42. Es una aproximación terapéutica de base humanista, indicada principalmente en las fases avanzadas del proceso neurodegenerativo, que se basa en una actitud de respeto y empatía con el enfermo, con la pretensión de respetar la realidad del paciente al aceptar sus creencias y vivencias63. Proponen una comunicación con el paciente basada, entre otros recursos, en el uso de palabras no amenazadoras, repetir lo esencial del discurso del enfermo (parafrasear), utilizar un tono de voz amable y suave, no contradecir al paciente y mantener un contacto ocular próximo y sincero. En relación con su eficacia no hay suficiente evidencia de ensayos aleatorizados para formular alguna conclusión feaciente42. Sin embargo, estudios observacionales han indicado que tiene efectos positivos respecto a la cantidad y duración de las interacciones sociales y, en consecuencia, esta técnica puede ofrecer un marco potencialmente valioso para la comunicación100.
Terapia de remotivación101-102
Es una terapéutica de resocialización, desarrollada por Dorothy Hoskins Smith en 1957, y fundamentada en los significados personales del propio enfermo42. Se trata de buscar aquellos aspectos que motivan al paciente (cumpleaños, vacaciones o aficiones) para activarse en la interacción social.
Programas de intervención para familiares
En la actualidad es incuestionable que todo proceso neurodegenerativo implica dos fuentes: el paciente con demencia y su entorno familiar más inmediato. Si bien la intervención en el paciente ocupa un lugar predominante en todo tratamiento farmacológico y no farmacológico, la atención psicológica a la familia del enfermo con demencia es uno de los pilares en que se asienta, hoy por hoy, el tratamiento integral de las demencias103. La pérdida de autonomía e independencia funcional y los problemas de comportamiento son factores que incrementan el estrés del/los cuidador/res. En este proceso, será necesario no olvidarse de los familiares que son su principal apoyo y recurso social, brindándoles la información y ayuda que precisen41. Son estos últimos los que deben asumir la labor de cuidar y supervisar, así como de intentar modificar y encajar in situ el comportamiento anómalo que pueda manifestar el paciente. Dicha labor requiere de una atención de 24 horas al día y ello conlleva, invariablemente, a que el/los cuidador/es principal/es vayan reduciendo sus horas de descanso, de actividades de ocio, sus ingresos económicos y sufran un progresivo y mayor aislamiento social26, 103.
Como resultado de todo ello el/los cuidador/es principal/es pueden, fácilmente, claudicar y desarrollar enfermedades físicas y de la esfera emocional. Por tanto, y como consecuencia, se han planteado diversas intervenciones que se realizan con familias: el apoyo psicológico individual o grupal, programas educativos/formativos o psicoinformación sobre las demencias, conocimiento/información de las redes asistenciales del ámbito de la salud y social y asociaciones de familiares de pacientes con demencia. Dichas intervenciones pretenden reducir el conflicto familiar, disminuir el aislamiento social, mejorar el apoyo psicológico y social y proporcionar una ayuda directa ante los problemas específicos originados por la enfermedad26. El uso de dichas estrategias ha permitido constatar una disminución de las alteraciones emocionales en el/los cuidador/es principal/es104-105 y, en consecuencia, producir un impacto positivo en el paciente con demencia106-107.
ANÁLISIS PRELIMINARES DEL EFECTO DE UN PROGRAMA DE ESTIMULACIÓN COGNITIVA INTEGRAL EN PACIENTES CON DEMENCIA TIPO ENFERMEDAD DE ALZHEIMER
Sujetos y Métodos
Se ha planteado un estudio prospectivo observacional durante 12 meses de evolución de la enfermedad. La muestra en estudio se ha ido seleccionando en su totalidad de las consultas externas del Servicio de Psicogeriatría del Antic Hospital de Sant Jaume i Santa Magdalena de Mataró de acuerdo a los siguientes criterios de inclusión:
1. Diagnóstico de probable o posible enfermedad de Alzheimer de acuerdo a los criterios del NINCDS-ADRDA18, DSM-IV-TR16 y IDC-1017.
2. Puntuaciones de un máximo de 24 puntos y un mínimo de 10 según el Mini Examen del Estado Mental de Folstein108 o entre 28 y 14 puntos según el Mini Examen Cognoscitivo de Lobo109.
3. Leve o moderado deterioro cognitivo definido por la Escala de Deterioro Global (GDS) de Reisberg110 equivalente a una puntuación mínima de 4 y una puntuación máxima de 6.
4. Leve a moderado deterioro funcional determinado por la escala de Blessed111 y equivalente a una puntuación inferior a 15 puntos.
5. Ausencia de trastorno afectivo agudo, determinado por una puntuación máxima de 5 puntos en la Escala de Depresión Geriátrica de Yesavage112, que pudiera condicionar la posible participación activa del paciente en el programa de estimulación cognitiva integral.
De acuerdo a dichos criterios se incluyeron prospectivamente un total de 62 pacientes ambulatorios (46 mujeres y 16 varones) con diagnóstico de demencia senil tipo Alzheimer (DSTA). De forma aleatoria se fueron incluyendo prospectivamente bien al grupo de estimulación cognitiva integral, del Hospital de Día Psicogeriátrico ubicado en el Antic Hospital de Sant Jaume i Santa Magdalena de Mataró y con una capacidad máxima de 15 pacientes al día, bien al grupo control o de pacientes no estimulados cognitivamente. Los criterios de inclusión en el grupo de pacientes estimulados cognitivamente fueron, adicionalmente a los criterios anteriormente mencionados, los siguientes:
1. Ausencia de déficit sensorial, auditivo y/o visual, determinado por el historial médico, que pudiera condicionar la participación activa del paciente en el programa de estimulación cognitiva.
2. Ausencia de diagnóstico premórbido de un trastorno específico del aprendizaje.
3. Compromiso por parte de la familia de la asistencia al Hospital de Día Psicogeriátrico previamente establecida y programada. No se ha considerado motivo de exclusión el uso de anticolinesterásicos como tratamiento de la enfermedad de Alzheimer y se ha registrado como variable de estudio. Los pacientes asignados al grupo control no recibían ningún tratamiento cognitivo estructurado y estaban integrados en su hábitat familiar realizando las actividades que habitualmente llevaban a cabo y con la posible farmacoterapia anticolinesterásica instaurada por el neurólogo del Servicio de Geriatría del Antic Hospital de Sant Jaume i Santa Magdalena de Mataró.
De esta forma la muestra en estudio (tabla VII) ha quedado constituida por 24 pacientes con DSTA (22 mujeres y 2 varones) que han recibido un tratamiento de estimulación cognitiva integral con una media de edad de 79,8 + 6,5 años (media + DE), una evolución media de la enfermedad de 4,6 + 2,4 años (media + DE) y una escolarización media de 2,6 + 2,0 años (media + DE). Los pacientes que configuran el grupo control son 38 casos (24 mujeres y 14 varones) con una media de edad de 77,3 + 6,1 años (media + DE), una evolución media de la enfermedad de 3,7 + 1,8 años (media + DE) y una escolarización media de 2,8 + 2,0 años (media + DE). Ambos grupos son estadísticamente comparables respecto a la edad (z = 1,69; P = 0,09), años de evolución de la enfermedad (z = -0,21; P = 0,84) y años de escolarización (z = -1,39; P = 0,17).
Protocolo de exploración neuropsicológica basal y de seguimiento evolutivo cognitivo
Una vez establecido el diagnóstico de DSTA, todos los pacientes de la muestra han sido cognitivamente evaluados al inicio del estudio, previa asignación al grupo control o al grupo de intervención cognoscitiva, para establecer la denominada línea de base y, después, trimestralmente durante un periodo total de un año. Se ha aplicado la misma batería de pruebas cognitivas y funcionales que ha constituido la exploración neuropsicológica para la línea basal y para los cuatro seguimientos trimestrales. La evaluación de la eficacia terapéutica del programa de estimulación cognitiva integral se ha llevado a cabo mediante el denominado método de testing-the-limits, propuesto por Baltes113-114. Dicho procedimiento consiste en la aplicación repetida de un test tradicional, o conjunto de pruebas, de valoración cognitiva y funcional introduciendo como fase intermedia una o varias sesiones de entrenamiento sobre la misma tarea que compone el test. Con dicho procedimiento se puede obtener una medida cuantificada y objetiva de qué capacidad de reserva o plasticidad puede tener el paciente y, en consecuencia, cuánto puede mejorar un sujeto si se le suministra un entrenamiento cognitivo sistemático44, 53.
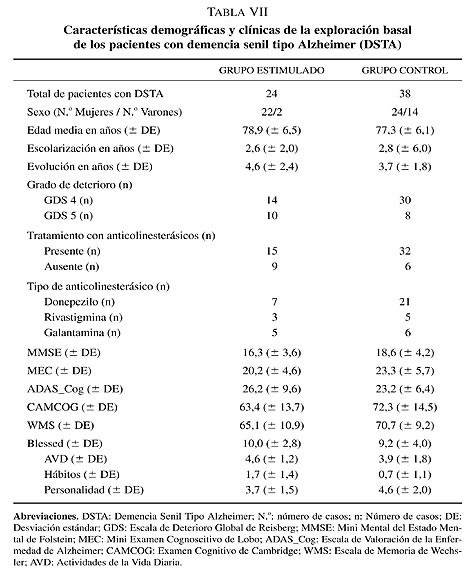
Los tests neuropsicológicos seleccionados para el seguimiento cognoscitivo, administrado siempre por el mismo neuropsicólogo experimentado, han sido los siguientes:
Mini Examen del Estado Mental de Folstein (MMSE)108
Instrumento de cribado ampliamente utilizado para la detección del deterioro cognitivo. Explora de forma breve y estandarizada, con buena fiabilidad y validez, un conjunto de funciones cognitivas tales como la orientación témporo-espacial, la memoria verbal inmediata y a corto plazo, la atención, el cálculo, el lenguaje (denominación, comprensión oral y escrita, repetición y lenguaje escrito espontáneo) y praxis constructiva. La puntuación final obtenida en este instrumento se ha utilizado habitualmente como índice global de deterioro cognitivo y como método de seguimiento evolutivo de las funciones neuropsicológicas en procesos neurodegenerativos. Su puntuación abarca un rango de 0 a 30 puntos y la puntuación de corte, como indicador de posible deterioro cognitivo, es de 24.
Mini Examen Cognoscitivo de Lobo (MEC)109
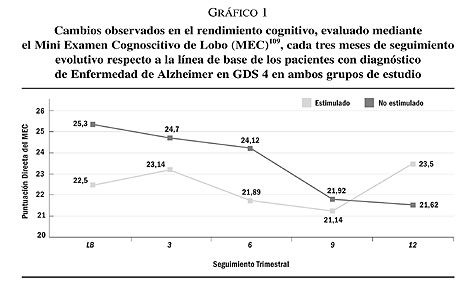
Instrumento de cribado para la detección del deterioro cognitivo. Explora de forma rápida y estandarizada un conjunto de funciones cognitivas tales como la orientación témporo-espacial, la memo-ria verbal inmediata y a corto plazo, la memoria verbal de trabajo, la atención, el cálculo, el lenguaje (denominación, comprensión oral y escrita, repetición y lenguaje escrito espontáneo), razonamiento abstracto y praxis constructiva. La puntuación final obtenida con este instrumento se puede utilizar como índice global de deterioro cognitivo y como método de seguimiento evolutivo de las funciones neuropsicológicas en procesos neurodegenerativos. Su puntuación abarca un rango de 0 a 35 puntos y la puntuación de corte, como indicador de posible deterioro cognitivo, es de 28 (ver gráfica 1).
Examen Cognitivo de Cambridge (CAMCOG)115
Herramienta de exploración cuyos objetivos son el diagnóstico de las demencias mediante el uso de los criterios operacionales establecidos, desarrollo de medidas válidas y fiables de la severidad y extensión de los déficit cognoscitivos y diseño de medidas fiables de puntuación de la conducta y nivel adaptativo de los pacientes. La prueba consta de 8 secciones de las cuales solamente se han utilizado la sección B o el examen cognitivo. Ésta consta de 57 ítems que se valoran en un global de 106 puntos, siendo el punto de corte de 79/80. Incluye 14 de los ítems del MMSE108 y MEC109 e incorpora nuevos ítems que valoran orientación, lenguaje, memoria, praxis, atención, pensamiento abstracto, percepción visual y cálculo.
Escala de Valoración de la Enfermedad de Alzheimer (ADAS)116-117
Instrumento que se ha utilizado habitualmente como índice global más sensible de deterioro cognitivo y como método de seguimiento evolutivo de las funciones neuropsicológicas en la DSTA. Explora un conjunto de funciones cognitivas tales como la orientación témporo-espacial, la memoria verbal de fijación, el reconocimiento verbal, el lenguaje (denominación, comprensión oral y lenguaje espontáneo), praxis constructiva y praxis ideacional. La puntuación total obtenida es equivalente al grado de errores cometidos por el paciente en cada uno de los ítems evaluados. Así, por consiguiente, se considera que a mayor puntuación directa se sugiere un mayor deterioro cognitivo. La puntuación directa final obtenida en este instrumento se transforma en un percentil de 25 a 99, corregido por la edad y años de estudio del paciente, y que sugiere la posibilidad de presencia o ausencia de deterioro cognitivo de acuerdo a un grupo de pacientes normales respecto a un grupo de pacientes con deterioro cognitivo leve o posible demencia degenerativa primaria tipo enfermedad de Alzheimer.
Escala de Memoria de Weschler (WMS)118
Instrumento psicométrico que posibilita la obtención de un cociente de memoria declarativa global mediante la evaluación de diferentes funciones mnésicas tales como la memoria remota, la orientación témporo-espacial, la memoria lógica verbal, la memoria verbal inmediata, la memoria verbal de trabajo, la memoria visual inmediata y el aprendizaje asociativo. La puntuación directa se transforma en un cociente mnésico, según edad, con una media de 100 y una desviación estándar de 15 puntos. Un cociente inferior a 85 es sugestivo de deterioro mnésico.
Escala de Deterioro de Blessed de Demencia111
Inventario constituido por 22 ítems que evalúan las modificaciones en las actividades de la vida diaria, alimentación, vestirse, control de esfínteres y trastornos de la personalidad y del comportamiento. La puntuación mínima es de 0 puntos y la máxima de 22. Más de nueve puntos en la escala implican una alteración significativa de la capacidad y de autonomía funcional.
Funcionamiento Cognitivo Global
Para determinar el estadio evolutivo y severidad del proceso degenerativo, en cada periodo de evaluación cognitiva y funcional, se ha utilizado la Escala de Deterioro Global (GDS) de Reisberg110 que ha sido completado por el neuropsicólogo evaluador.
Programa de estimulación cognitiva integral
Los pacientes asignados al grupo tratamiento recibieron un programa de estimulación cognitiva integral estructurado (tabla VIII) según los principios terapéuticos propuestos por Tárrega y colaboradores57, 78. Siempre fue administrado por el personal del Hospital de Día Psicogeriátrico de 10 de la mañana a 17 horas de la tarde, de acuerdo con la siguiente secuencia de trabajo: taller de orientación a la realidad, taller de atención y concentración, taller de memoria, taller de cálculo, estimulación de las actividades de la vida diaria mediante un programa de entrenamiento en memoria procedural (lavar los platos, preparar la mesa para la comida, recoger la mesa, lavarse los dientes, entre otras actividades), taller de psicomotricidad, taller de lenguaje y razonamiento y taller de reminiscencia.
Cada taller tenía una duración aproximada de 30 a 40 minutos dejándose un intervalo o periodo de descanso entre talleres de 10 a 15 minutos. Asimismo, el programa de estimulación cognitiva integral se centraba en el entrenamiento de las funciones cognitivas residuales de acuerdo al estadio evolutivo del proceso neurodegenerativo. Así, las tareas cognitivas del programa integral de estimulación cognoscitiva se han adecuado a los niveles de deterioro cognitivo determinados, con la siguiente especificación según el modelo de Tárrega y colaboradores60, 78 y Peña-Casanova63, estableciéndose dos grupos de trabajo:
Deterioro Cognitivo Leve-Moderado o GDS 4
Se han planteado ejercicios de atención que han ayudado a reforzar la activación mental, ejercicios de orientación a la realidad, de memoria, de concepto numérico y de cálculo, de razonamiento verbal, de lenguaje escrito y de praxis constructivas.
Deterioro Cognitivo Moderado o GDS 5
El trabajo de estimulación cognitiva se ha focalizado en el mantenimiento de la atención, ejercicios de orientación a la realidad, de memoria remota y de fijación utilizando ayudas de clave fonética y semántica, en el lenguaje escrito en sus capacidades residuales, en el reconocimiento numérico y en el cálculo, la percepción y reconocimiento visual, en el razonamiento verbal abstracto y en las praxis constructivas.

Análisis Estadístico
Los datos se han introducido en una base de datos de la versión décima para Windows del Paquete Estadístico para las Ciencias Sociales (SPSS, 2001)119. Se ha efectuado un análisis preliminar no paramétrico de comparación de medias de 2 muestras independientes mediante la prueba de la U de Mann-Whitney. Se ha comparado el índice de mejora cognitiva estipulado entre el grupo de pacientes que han recibido estimulación cognitiva integral y el grupo de pacientes que configuran el grupo control. Se ha utilizado un intervalo de confianza del 95% para la significación estadística.
Resultados
En la presente comunicación se exponen los resultados de un análisis estadístico preliminar de los datos obtenidos. Así, un total de 62 pacientes han sido evolutivamente controlados y han configurado la muestra de estudio. No obstante, hay que remarcar que del total de la muestra de estudio tan sólo 29 pacientes han podido completar las cuatro fases de seguimiento trimestral (doce meses de seguimiento) o de control evolutivo cognoscitivo, un 34,5% de casos (n = 10) pertenecientes al grupo de tratamiento cognitivo y un 65,5% de pacientes (n = 19) pertenecientes al grupo control (tabla IX). Los motivos de baja durante el periodo de seguimiento neuropsicológico del grupo tratado cognitivamente han sido bien el ingreso en una residencia geriátrica (n = 6) bien la muerte del paciente (n = 1).
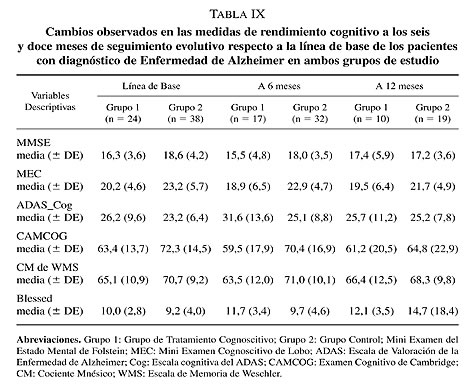
Para evaluar la eficacia de la estimulación cognitiva integral se ha calculado el Índice de Cambio Cognitivo (ICC)36, 53. Este índice permite definir el grado de deterioro cognitivo de cada paciente al comparar el cambio de rendimiento neuropsicológico observado en la puntuación obtenida en cada una de las pruebas cognoscitivas utilizadas en los controles evolutivos cognitivos de seguimiento respecto a la línea de base. La fórmula para calcular el ICC es la siguiente: Puntuación de la prueba cognitiva en la línea de Base 2 Puntuación de la prueba cognitiva en la fase de seguimiento evolutivo obtenido. Así, una puntuación con signo positivo más alejada de un valor 0 sugiere un mayor grado de deterioro cognitivo. Contrariamente, una puntuación con signo negativo más alejada de 0 indica una mejora del rendimiento cognitivo.
Se ha efectuado un análisis del ICC, para cada una de las pruebas neuropsicológicas utilizadas como control cognitivo y funcional, únicamente con los pacientes con un deterioro cognitivo leve a moderado según la Escala de Deterioro Global correspondiente a un GDS 4 de Reisberg110 para poder controlar el efecto grado de deterioro. De acuerdo con ello no se constata una diferencia en el rendimiento cognitivo y funcional, entre ambos grupos en estudio, a los seis meses de seguimiento para cada una de las pruebas neuropsicológicas administradas (z = -0,89; P = 0,38 para el MEC; z = -0,20; P = 0,85 para el MMSE; z = -1,78; P = 0,08 para el ADAS_Cog; z = -0,37; P = 0,74 para el CAMCOG; z = -0,52; P = 0,61 para la WMS; z = -0,09; P = 0,93 para el Blessed). Contrariamente, según las puntuaciones del MEC, se objetiva un mayor deterioro cognitivo en el grupo de pacientes no tratados con estimulación cognitiva a los 12 meses de seguimiento respecto al grupo de pacientes tratados (z = -2,07; P = 0,036) (gráfico 1). Resultados similares se constatan respecto al MMSE y el ADAS (tabla IX). Es decir, los pacientes con DSTA que han recibido tratamiento cognitivo muestran una recuperación del deterioro cognitivo a los 12 meses de seguimiento respecto a los pacientes del grupo control (z = -2,03; P = 0,046 para el MMSE y z = -2,11; P = 0,036 para el ADAS). No hay cambios estadísticamente significativos entre ambos grupos a los 12 meses de evolución ni en las puntuaciones obtenidas en el CAMCOG (z = -0,97; P = 0,37) ni en las puntuaciones obtenidas en la WMS (z = -1,27; P = 0,21), aunque se constata una clara tendencia a la mejora del rendimiento neuropsicológico para el grupo de pacientes con DSTA tratado cognitivamente (tabla IX). Finalmente, se observa un claro empeoramiento funcional en el grupo control (tabla IX), a los 12 meses de seguimiento, respecto al grupo de pacientes con DSTA tratado cognitivamente, si bien no se alcanza una significación estadística (z = -0,51; P = 0,62).
DISCUSIÓN
En el presente estudio prospectivo y observacional se ha efectuado un análisis estadístico preliminar del efecto terapéutico de un programa de estimulación cognitiva integral en una muestra de pacientes con demencia senil tipo Alzheimer (DSTA) con un grado de deterioro cognitivo de leve a moderada intensidad. Según la evolución del rendimiento neuropsicológico observado en el Mini Examen Cognoscitivo de Lobo (MEC)108, el Mini Examen Mental de Folstein (MMSE)109 y la Escala de Valoración de la Enfermedad de Alzheimer (ADAS)116-117, los pacientes con DSTA que han recibido un tratamiento de estimulación cognoscitiva presentan un menor deterioro cognitivo a los doce meses de seguimiento, e incluso una mejora de su rendimiento neuropsicológi-co, respecto a un grupo de pacientes con DSTA, y con el mismo grado de evolución según la Escala de Deterioro Global (GDS) de Reisberg110, que no han recibido dicha intervención terapéutica.
Los tratamientos de estimulación cognitiva o no farmacológica, como alternativa terapéutica en los procesos neurodegenerativos, son conocidos desde hace más de medio siglo aunque han sido relativamente utilizados53. Además, y a pesar de su longevidad, su eficacia terapéutica permanece todavía cuestionada al ser pocos los trabajos que han comprobado su efectividad con una metodología de estudio adecuada26. Por otra parte, la mayoría de los trabajos científicos han tenido como objetivo prioritario el demostrar la eficacia terapéutica de una técnica en comparación a otro tipo de intervención cognitiva, olvidando, en muchos casos, la delimitación y definición de la población en estudio52.
La primera de las técnicas de estimulación cognitiva descrita fue la terapia de orientación a la realidad por Taulbee y Folsom en 1966 y se fundamenta en la reorientación del paciente demente mediante una estimulación repetitiva43, 46, 50, 79. Dicho proceso de intervención cognoscitiva parece beneficiar al paciente demente, mejorando la orientación y la memoria43, 50, 52, si bien la mejora en otras funciones cognitivas parece limitada51. Los procedimientos terapéuticos centrados en la estimulación y entrenamiento de funciones cognitivas específicas tales como la atención, la memoria semántica y las funciones lingüísticas parecen mejorar el rendimiento cognitivo básico, evaluado mediante el MMSE y la memoria de fijación45, 52, si bien no tiene ningún efecto positivo en las actividades de la vida diaria45. También se ha propuesto como tratamiento no farmacológico el uso de un programa de actividades lúdicas o recreativas y la arte-terapia52. Existe alguna evidencia de que dichas intervenciones pueden hacer disminuir los problemas de comportamiento y mejorar el estado afectivo del paciente demente44, aunque la eficacia de este procedimiento terapéutico no es firme52.
Otro tipo de intervención cognoscitiva utilizada en los pacientes dementes se enmarca en un grupo de técnicas que hacen mayor hincapié en el componente emocional. Entre ellas destaca la terapia de la reminiscencia que postula que al hacer que el paciente reviva conscientemente experiencias pasadas y conflictos no resueltos posibilita preparar al enfermo para la muerte. No obstante, diversos estudios solamente han demostrado cierta eficacia en el tratamiento de las alteraciones del comportamiento43. Otra técnica que se enmarca en dicha línea de intervención es la denominada terapia de validación desarrollada por Naomi Feil entre 1963 y 198097-99. Ésta se fundamenta en el contacto ocular y físico y la capacidad del terapeuta para escuchar empáticamente al paciente demente. Si bien algunos trabajos han demostrado un efecto positivo en la capacidad de socialización del paciente, otros estudios concluyen que su eficacia terapéutica no es del todo fiable52.
Un reciente programa de estimulación cognitiva, que se ha introducido como nueva técnica de intervención no farmacológica, se fundamenta en el aprendizaje de procedimientos al entrenar al paciente en actividades básicas e instrumentales de la vida diaria48. Algunos estudios defienden la aplicación de dicha técnica al sugerir que la estimulación de la memoria procedural puede ser más efectiva que la estimulación de funciones cognitivas residuales52. Esto es posible puesto que el aprendizaje procedural, un tipo de memoria implícita, está preservado en los pacientes con DSTA hasta fases muy avanzadas de la enfermedad3, 4, 22. Algunos trabajos han demostrado que mediante este tipo de intervención el paciente demente mejora no tan sólo el funcionamiento autónomo diario sino también algunas funciones cognitivas residuales48, 52.
Actualmente, hoy nadie parece poner en duda el hecho de que la estimulación cognoscitiva parece poder mejorar el funcionamiento cognitivo y la calidad de vida del paciente demente, e incluso, en un nivel similar al efecto terapéutico atribuible a los anticolinesterásicos53. Sin embargo, a pesar de la literatura ya existente sobre la eficacia de intervención no farmacológica en el paciente demente no hay muchos estudios que hayan evaluado un programa de estimulación cognitiva integral y sistemático78. El presente trabajo ha utilizado dicho tipo de intervención con el propósito de estimular el mayor número posible de funciones cognitivas preservadas29, 57, 62-63 en base a un conjunto de actividades organizadas y de talleres programados adecuados al grado de deterioro cognoscitivo del paciente y, por tanto, a las capacidades residuales del mismo29, 55, 57. Este tipo de intervención conlleva la aplicación de diversas técnicas de intervención no farmacológica, previamente descritas, con el propósito de retardar el curso evolutivo de la enfermedad78. La aplicación de dicho tipo de intervención cognitiva parece, según el análisis preliminar de los datos del presente estudio, retrasar el deterioro cognitivo de los pacientes con DSTA.
Por otro lado, una gran parte de los estudios de revisión sobre la eficacia de la intervención cognitiva en los pacientes con DSTA han sido multicéntricos. Es decir, el programa de intervención cognoscitiva ha sido aplicado por diversos terapeutas en los correspondientes centros de atención en que se encontraba ingresado el enfermo. Ello puede provocar una significativa variación de la aplicación de la intervención cognitiva y, en consecuencia, en el efecto de las medidas neuropsicológicas, conductuales y afectivas de seguimiento registradas53. El presente trabajo se ha efectuado íntegramente en el Hospital de Día Psicogeriátrico de l’Antic Hospital de Sant Jaume i Santa Magdalena de Mataró y, habitualmente, siempre con el mismo personal que ha aplicado el programa de estimulación cognitiva integral. Ello, conjuntamente con los rigurosos criterios de inclusión, ha podido condicionar el número total de pacientes evaluados y controlados evolutivamente en beneficio de obtener un grupo razonablemente homogéneo de estudio y posibilitando la homogeneización de la intervención y la metodología terapéutica a seguir.
Otra limitación de la literatura actual es que mayoritariamente se evalúa la eficacia terapéutica tras administrar un número limitado de sesiones de estimulación cognitiva. Es decir, no se ha contemplado la posibilidad de que para poder mantener y quizá registrar más significativamente los beneficios terapéuticos debe instaurarse la estimulación, al igual que se ha llevado a cabo con ciertos fármacos anticolinesterásicos36, de forma regular y durante un largo periodo de tiempo48, 52-53. El presen-te estudio ha mantenido el programa de estimulación integral durante un periodo mínimo de 12 meses en muchos de los pacientes dementes. El seguimiento evolutivo de las capacidades cognoscitivas ha permitido constatar que el beneficio de un programa de estimulación cognitiva integral se instaura de forma progresiva y puede objetivarse su efecto al cabo de un largo periodo de tiempo. De hecho, los datos prelimares del presente estudio muestran cómo los pacientes dementes tratados con un programa de estimulación cognitiva integral mantienen su nivel de ejecución neuropsicológica e, incluso, mejoran significativamente y de forma progresiva su rendimiento cognitivo al cabo de doce meses de intervención no farmacológica. Ello permite postular que el tratamiento cognitivo parece tener su efecto terapéutico, cuanto menos, en el retardo del curso evolutivo de la enfermedad neurodegerativa. No obstante, no debe olvidarse que el potencial efecto de este tipo de tratamiento puede aumentar con la combinación de una intervención farmacológica39, 53.
Finalmente, la mayoría de los trabajos que han evaluado la eficacia terapéutica de la intervención no farmacológica lo han llevado a cabo mediante pruebas cognitivas de cribado de sencilla y rápida administración. Pocos son los trabajos que han diseñado una batería específica de control evolutivo cognitivo y funcional. El presente trabajo ha seleccionado y aplicado una batería neuropsicológica introduciendo aquellas pruebas de evaluación cognoscitiva y funcional específicamente diseñadas para un control cognitivo evolutivo y que han demostrado sensibilidad al cambio tras una intervención farmacológica y no farmacológica15-117. Adicionalmente, se ha administrado una prueba psicométrica que evalúa específicamente diversas funciones mnésicas118. Los resultados preliminares confirman, provisionalmente, que una intervención no farmacológica mediante un programa de estimulación cognitiva integral parecen enlentecer el curso evolutivo de la enfermedad de Alzheimer observándose sus efectos terapéuticos, en comparación con un grupo no tratado cognitivamente, a largo plazo.
No cabe duda que las diferentes técnicas de estimulación cognitiva o de tratamiento no farmacológico, encaminadas a estimular las capacidades neuropsicológicas residuales o preservadas de pacientes con un proceso neurodegenerativo en curso, han estado dispersas y no siempre bien diferenciadas en la literatura existente60. Todos los programas revisados parecen proporcionar datos alentadores respecto a su eficacia26. No obstante, y en primer lugar, es necesario profundizar en la validación de las diferentes estrategias de intervención cognitiva en el tratamiento de las demencias mediante ensayos clínicos metodológicamente bien diseñados, un adecuado sistema del análisis de resultados y considerar o tener en cuenta el número de la muestra en estudio. Finalmente, y en segundo lugar, contemplar que el efecto terapéutico de la intervención cognitivo-conductual en las demencias no sólo debe estudiarse en la esfera cognitiva de los pacientes con un diagnóstico de un proceso neurodegenerativo sino que dicha intervención puede incidir positivamente en diversas áreas tales como la familiar, la esfera funcional o la conductual.
BIBLIOGRAFÍA
1. Berrios GE. Dementia: Historical overview. In Burns A, Levy R, editors. Dementia. London: Chapman Hall, 1994: 5-19.
2. Martínez Lage JM, Álvarez P. Concepto, criterios diagnósticos y visión general de las demencias. En López-Pousa S, Vilalta-Franch J, Llinás-Reglá J, editores. Manual de demencias. Barcelona: Prous Science, 1996: 14-44.
3. Deus J, Pujol J, Amores F, et al. Neuropsicología de la enfermedad de Alzheimer y otras demencias primarias. En Deví J, Deus J, editores. Las demencias y la enfermedad de Alzheimer: una aproximación práctica e interdisciplinar. Barcelona: Isep Universidad, 2004: 385-418.
4. Mesulam MM. Aging, Alzheimer’s disease, and dementia. In Mesulam MM, editor. Principles of behavioral and cognitive neurology. New York: Oxford University Press, 2000: 439-522.
5. Bolla LR, Filley CM, Palmer RM. Dementia DDX: Office diagnosis of the four major types of dementia. Geriatrics, 2000; 55: 34-46.
6. Knopman DS, DeKosky ST, Cummings et al. Practice parameter: diagnosis of dementia (an evidence-based review). Report of the Quality Stand. Subcommitte of the American Academy of Neurology. Neurology, 2001; 56: 1143-1153.
7. Marsden CD. Assessment of dementia. In Fredericks JAM, editor. Handbook of clinical neurology, Vol. 2 (46): Neurobehaviorals disorders. Amsterdam: Elsevier Publisher, 1985: 221- 232.
8. SEP. Consenso Español de Demencias. Madrid: Drug Pharma; 2000.
9. Alzheimer A. Uber eine eigenartige Erkrangkung der Hirnrinde. Allgemeine Zeitschrift für Psychiatrie und Psychisch-Gerichtline Medizin, 1907; 64: 146-148.
10. Kawas C, Brookmeyer R. Aging and the public health effects of dementia. N Engl J Med, 2001; 334: 1160-1161.
11. López-Pousa S. Definición y epidemiología de la enfermedad de Alzheimer. En Alberca R, López-Pousa S, editores. Enfermedad de Alzheimer y otras demencias. Madrid: Editorial Médica Panamericana, 2002: 147-156.
12. Martínez Lage JM. Demencias: historia y concepto. En Alberca R., López-Pousa S. Editores. Enfermedad de Alzheimer y otras demencias. Madrid: Editorial Médica Panamericana, 1998: 23-34.
13. Boller F, Duyckaerts C. Alzheimer disease: clinical and anatomic aspects. In Feinberg TE, Farah MJ, editors. Behavioral neurology and neuropsychology. New York: McGraw-Hill, 1997: 521-544.
14. Katzman R, Terry R, Bick K. Alzheimer’s disease: senile dementia and related disorders. New York: Raven Press, 1978: 595.
15. Capitani E, Della-Sala S y Spinnler H. Controversial neuropsychological issues in Alzheimer’s disease: influence of onset-age and hemispheric asymmetry of impairment. Cortex, 1990; 26: 133-145.
16. Diagnostic and Statistical Manual of Mental Disorders (DSM), 4d ed rev (DSM-IV-TR). Washington, DC: American Psychiatric Association; 2000.
17. Organización Mundial de la Salud (OMS). CIE-10-Décima revisión de la clasificación internacional de las enfermedades. Trastornos mentales y del comportamiento. Criterios diagnósticos de investigación. Organización Mundial de la Salud. División de la Salud Mental. Ginebra: Meditor, Madrid, 1994.
18. McKhann G, Drachman D, Folstein M et al. Clinical diagnosis of Alzheimer’s disease: report of the NINCDS-ADRDA. Work group under the auspices of Department of Health and Human Services Task Force on Alzheimer’ Disease. Neurology, 1984; 34: 939-944.
19. Constantinidis J, Richard J. Alzheimer’s disease. In Fredericks JAM, editor. Handbook of clinical neurology, Vol. 2 (46): Neurobehavioral disorders. Amsterdam: Elsevier Publisher, 1985: 247-282.
20. Alberca R. Demencias degenerativas corticales de comienzo focal. En Alberca R, López-Pousa S, editores. Enfermedad de Alzheimer y otras demencias. Madrid: Editorial Médica Panamericana, 2002: 349-354.
21. Peña-Casanova J, Bertrán-Serra I. Limb praxis patterns in early-moderate stages of dementia of the Alzheimer type. Rev Neurol, 1993; 21: 240-243.
22. Eslinger PJ, Damasio AR. Preserved motor learning in Alzheimer’s disease. Implications for anatomy and behaviour. J Neurosci, 1986; 6: 3006-3009.
23. Heindel WC, Salmon DP, Shults CW, Walicke PA, Butters N. Neuropsychological evidence for multiple implicit memory systems. A comparison of Alzheimer’s, Huntington’s and Parkinson’s disease patients. J Neurosci, 1989; 9: 582-587.
24. Nebes RD. Alzheimer’s disease: cognitive neuropsychological aspects. In Feinberg TE, Farah MJ editors. Behavioral neurology and neuropsychology. New York: McGraw-Hill, 1997: 545-550.
25. Bouchard R, Rossor MN. Typical clinical features. In Gauthier S, editor. Clinical diagnosis and management of Alzheimer’s disease. London: Martin Dunitz Publishers, 1996: 35-50.
26. Barandiarán-Amillano M. Programas de psicoestimulación cognitiva en las demencias. En Manubens Bertrán JM, Berthier Torres M, Barquero Jiménez S, editores. Neurología conductual: fundamentos teóricos y prácticos. Barcelona: Pulso ediciones, 2002: 307-319.
27. Boada M, Tárrega Ll. El tratamiento longitudinal de la enfermedad de Alzheimer. Continua Neurológica, 1998; 1: 82-106.
28. Winblad B, Poritis N. Memantine in severe dementia: results of the 9M-Best Study (Benefit and efficacy in severely demented patients during treatment with memantine). Int J Geriatr Psychiat, 1999; 14: 135-146.
29. Tárrega Mestre Ll. El programa de psicoestimulación integral, tratamiento complementario para la enfermedad de Alzheimer. Rev Esp de Geriatr Gerontol, 2000; 35: 51-64.
30. Samuel W, Galasko D, Thal LJ. Alzheimer disease: biochemical and pharmacologic aspects. In Feinberg TE, Farah MJ, editors. Behavioral neurology and neuropsychology. New York: McGraw-Hill, 1997: 551-569.
31. Knapp M, Knopman DS, Soloman PR, et al. A 30-week randomised controlled trial of high-dose tacrine in patients with Alzheimer’s disease. JAMA, 1994; 271: 985-991.
32. Summers WK, Majovski LV, Marsh GM, Tachiki K, Kling A. Oral tetrahydroaminoacridine in long-term treatment of senile dementia, Alzheimer type. N Engl J Med, 1986; 315: 1241-5.
33. Winblad B, Engedal K, Soininen H, et al. A 1-year, randomised, placebo-controlled study of donepezil in patients with mild to moderate AD. Neurology, 2001; 57: 489-495.
34. Rösler M, Amand R, Cicin-Sain A, et al. Efficacy and safety of rivastigmine in patients with Alzheimer’s disease: international randomised controlled trial. Brit Med J, 1999; 318: 633-638.
35. Livingston G, Katona C. How useful are cholinesterase inhibitors in the treatment of Alzheimer’s disease? A number needed to treat analysis. Int J Geriatr Pyschiat, 2000; 15: 203-207.
36. Wilcock G, Howe I, Coles H, et al. A long-term comparison of galantamine and donepezil in the treatment of Alzheimer’s disease. Drugs Aging, 2003; 20: 777-789.
37. Areosa SA, Sherriff F, McShane R. Memantine for dementia. Cochrane Database Syst Rev, 2005; 20: CD003154.
38. Lleo A, Greenberg SM, Growdon JH. Current Pharmacotherapy for Alzheimer’s Disease. Annu Rev Med, 2006; 57: 1-21.
39. Arroyo-Anlló EM. Estimulación psicocognoscitiva y comportamental en la demencia. En Arroyo-Anlló EM, editora. Estimulación psicocognoscitiva en las demencias. Programas de talleres de estimulación. Barcelona: Prous Science, 2002: 35-49.
40. Alberca Serrano R. Tratamiento farmacológico de la enfermedad de Alzheimer. En Alberca R, López-Pousa S, editores. Enfermedad de Alzheimer y otras demencias. Madrid: Editorial Médica Panamericana, 1998: 319-335.
41. Requena E, Hervás E, Nagés N, Cullell N. Eficacia de los programas de psicoestimulación. En Deví J, Deus J, editores. Las demencias y la enfermedad de Alzheimer: una aproximación práctica e interdisciplinar. Barcelona: Isep Universidad, 2004: 535-557.
42. Martí P, Mercadal M, Cardona J, Ruiz I, Sagristá M, Mañós Q. Intervención no farmacológica en las demencias y la enfermedad de Alzheimer: miscelánea. En Deví J, Deus J, editores. Las demencias y la enfermedad de Alzheimer: una aproximación práctica e interdisciplinar. Barcelona: Isep Universidad, 2004: 559-587.
43. Baines S, Saxby P, Ehlert K. Reality orientation and reminiscence therapy: a controlled cross-over study of elderly confused people. Brit J Psychiat, 1987; 151: 222-231.
44. Karlsson I, Brane G, Melin E, Nyth AI, Rybo E. Effects of environmental stimulation on biochemical and psychological variables in dementia. Acta Psychiatr Scand, 1988; 77: 207-213.
45. Breuil V, De Rotrou J, Forette F, et al. Cognitive stimulation of patients with dementia: preliminary results. Int J Geriatr Pyschiat, 1994; 9: 211-217.
46. Zanetti O, Frisoni GB, De Leo D, et al. Reality orientation therapy in Alzheimer disease: useful or not? A controlled study. Alz Dis Assoc Dis, 1995; 9: 132-138.
47. Bäckman L. Utilizing compensatory task conditions for episodic memory in Alzheimer’s disease. Acta Neurol Scand, 1996; 165(Suppl.): 109-113.
48. Zanetti O, Binetti G, Magni E, et al. Procedural memory stimulation in Alzheimer’s disease: impact of training programmer. Acta Neurol Scand, 1997; 95: 152-157.
49. American Psychiatric Association (APA). Practice guidelines. Workgroup on Alzheimer’s disease and related disorders. In Rabin P, editor. Practice guidelines for the treatment of patients with Alzheimer’s disease and other dementias. Am J Psychiat, 1997; 154 (Suppl.).
50. Spector A, Orrell M, Davies S, et al. Reality orientation for dementia: a systematic review of the evidence of effectiveness from randomised controlled trials. Gerontologist, 2000; 40: 206-212.
51. Spector A, Orrell M, Davies S, et al. Can reality orientation be rehabilitated? Development and piloting of an evidence-based programme of cognition-based therapies for people with dementia. Neuropsychol Rehab, 2001; 11: 377-397.
52. Farina E, Fioravanti R, Chiavari L, et al. Comparing two programs of cognitive training in Alzheimer’s disease: a pilot study. Acta Neurol Scand, 2002; 105: 365-371.
53. Spector A, Thorgrimsen L, Woods B, et al. Efficacy of an evidence-based cognitive stimulation therapy programme for people with dementia. Brit J Psychiat, 2003; 183: 248-254.
54. Fernández-Ballesteros R, Calero MD. Training effects on intelligence of older persons. Arch Gerontol Geriat, 1995; 20: 135-148.
55. Calero MD, Navarro E, Arnedo ML, García-Berben TM, Robles P. Estimación del potencial de rehabilitación en ancianos con y sin deterioro cognitivo asociado a demencias. Rev Esp Geriatr Gerontol, 2000; 35: 44-50.
56. Guzmán E. Rehabilitación de funciones mentales superiors. Contribuciones de la neuropsicología. Arch Neurobiol, 1993; 2: 89-99.
57. Tárrega Mestre Ll. Tratamiento no farmacológico de las demencias. En Alberca R, López-Pousa S, editores. Enfermedad de Alzheimer y otras demencias. Madrid: Editorial Médica Panamericana, 2002: 121-133.
58. Holland AL. Rehabilitación cognitiva y conductual en la enfermedad de Alzheimer. En Martínez-Lage Jm, Khachaturian AS, editores. Alzheimer XXI: Ciencia y Sociedad. Barcelona: Masson, 2001: 305-313.
59. NIH Consensus Development Conference on the Rehabilitation of Persons with Traumatic Brain Injury. NICHD, 1999; 12.
60. Tárrega Ll. Terapias blandas: Programa de Psicoestimulación Integral. Alternativa terapéutica para las personas con enfermedad de Alzheimer. Rev Neurol, 1998; 27(Suppl.): 51-62.
61. Taft LB, Fazio S, Seman D, et al. A psychological model of dementia care: theoretical and empirical support. Arch Psychiatr Nurs, 1997; 11: 13-20.
62. Tárrega Ll. Estrategia no farmacológica del deterioro cerebral senil y demencia. Medicine, 1994; 6: 44-53.
63. Peña-Casanova J. Tratamiento no farmacológico (cognitivo). EN Peña-Casanova J, editor. Enfermedad de Alzheimer. Del diagnóstico a la terapia: conceptos y hechos. Barcelona: Fundació ‘La Caixa’, 1999: 94-98.
64. Tárrega Ll. Tratamientos de psicoestimulación. En Fernández-Ballesteros R, Díez-Nicolás J, editores. Libro blanco sobre la enfermedad de Alzheimer y trastornos afines. Madrid: Caja Madrid Obra Social, 2001: 305-322.
65. Vega Jl, Bueno B. Biología y salud. En Vega Jl, Bueno B, editores. Desarrollo adulto y envejecimiento. Madrid: Síntesis, 1996: 58-106.
66. Perlmutter LS, Scott SA, Barron E, Chui HC. MHC class II-positive microglia in human brain: association with Alzheimer’s lesions. J Neurosci Res, 1992; 33: 549-558.
67. Stern Y. The concept of cognitive reserve: a catalyst for research. Clin Exp Neuropsychol, 2003; 25: 589-93.
68. Mortimer JA. Brain reserve and the clinical expression of Alzheimer’s disease. Geriatrics, 1997; 52(Suppl. 2): 50-3.
69. Mahieux F, Gély-Nargeot MC. Classification des troubles cognitifs lies à l’âge. In Derouesné MC, Gély-Nargeot MC, editors. De la plainte mnésique aux stades précoces de l’Alzheimer. Marseille: Solal, 1997: 85-98.
70. Geschwind N. Mechanism of change after brain after brain lesions. In Nottebohm E, editor. Hope for a new neurology. Ann Acad N Y, 1995; 457: 1-11.
71. Goldman S. Neurogénesis and neuronal precursor cells in the adult forebrain. Neuroscientists, 1995; 1: 338-350.
72. Thompson CK. Neuroplasticity: evidence from aphasia. J Commun Disord, 2000; 33: 229-30.
73. Schliebs R. Neuronal plasticity and degeneration. Int J Dev Neurosci, 2001; 19: 229-230.
74. Mikkonen M, Soininen H, Alafuzof I, Miettinen R. Hippocampal plasticity in Alzheimer’s disease. Rev Neurosci, 2001; 12: 311-325.
75. Teter B, Ashford JW. Neuroplasticity in Alzheimer’s disease. J Neurosci Res, 2002; 170: 402-437.
76. Goldman S, Plum F. Compensatory regeneration of the damaged adult human brain: neuroplasticity in a clinical perspective. In Freud HJ, Sabel BA, Witte HOW, editors. Brain plasticity, 1997: 99-107.
77. Luria C. El diagnóstico neuropsicológico de Luria. Madrid: Visor, 1976.
78. Deví J, Magna S, Ruiz I. Escalas de evaluación psicopatológicas y psicogeriátricas. En Deví J, Deus J, editores. Las demencias y la enfermedad de Alzheimer: una aproximación práctica e interdisciplinar. Barcelona: Isep Universidad, 2004: 511-533.
79. Deví J, Olivera C, Cardona J. Escalas de valoración funcional en geriatría y en las demencias. En Deví J, Deus J, editores. Las demencias y la enfermedad de Alzheimer: una aproximación práctica e interdisciplinar. Barcelona: Isep Universidad, 2004: 273-298.
80. Powell-Proctor L, Miller E. Reality orientation: a clinical appraisal. Br J Clin Psychol, 1982; 26: 83-91.
81. Thornton S, Brotchie J. Reminiscence: a critical review of the empirical literature. Br J Clin Psychol, 1987; 26: 93-111.
82. Reisberg B, Franssen EH, Souren LE, Auer SR, Akram I, Kenowsky S. Evidence and mechanisms of retrogenesis in Alzheimer’s and other dementias: management and treatment import. Am J Alzheimers Dis Other Demen. 2002; 17: 202-12.
83. Piaget J, Indelher B. Psicología del niño. Madrid: Morata, 1975.
84. Beck C, Heacock P, Mercer S, et al. The impact of cognitive skills remediation training on persons with Alzheimer’s disease or mixed dementia. J Geriatr Psychiatry, 1988; 21: 73-88.
85. Davis RN, Massman PJ, Doody RS. Cognitive intervention in Alzheimer disease: a randomized placebo-controlled study. Alzheimer Dis Assoc Disord, 2001; 15: 1-9.
86. Quayhagen MP, Quayhagen M. Differential effects of family-based strategies on Alzheimer’s disease. Gerontologist, 1989; 29: 150-5.
87. Yesavage JA. Nonpharmacologic treatments for memory losses with normal aging. Am J Psychiatry, 1985; 142: 600-605.
88. Camp CJ, Foss JW, Stevens AB, et al. Memory training in normal and demented elderly populations: the E-I-E-I-O model. Exp Aging Res, 1993; 19: 277-290.
89. McKitrick LA, Camp CJ, Black FW. Prospective memory intervention in Alzheimer’s disease. J Gerontol, 1992; 47: 337-43.
90. Ermini-Fünfschilling D, Hendriksen C, Meier D, Regard M, Stähelin H. Cognitive training for mildly demented out-patients: Effects on mood and cognitive functions. In Vellas B, Fit-ten J, Frisoni G, editors. Research and Practice in Alzheimer’s Disease. New York: Springer, 1998: 389-400.
91. Kydd P. Using music therapy to help a client with Alzheimer’s disease adapt to long-term care. Am J Alzheimers Dis Other Demen, 2001; 16: 103-8.
92. Brotons M, Koger SM. The impact of music therapy on language functioning in dementia. J Music Ther, 2000; 37: 183-95.
93. American Music Therapy Association. AMTA member sourcebook 2002. Silver Spring: American Musis Therapy Association, Inc. 2002.
94. Olivera C, Ortega M. Terapia ocupacional y fisioterapia en geriatría y en las demencias. En Deví J, Deus J, editores. Las demencias y la enfermedad de Alzheimer: una aproximación práctica e interdisciplinar. Barcelona: Isep Universidad, 2004: 589-611.
95. Durante-Molina P, Polonio-López B. Centro de Día Psicogeriátrico: abordajes no farmacológicos. Intervención desde la terapia ocupacional. Rev Esp Geriatr Gerontol, 1996; 31: 51-61.
96. Cohen-Mansfield J. Measurement of inappropriate behaviour associated with dementia. J Gerontol Nurs, 1999; 25: 42-41.
97. Neil M, Briggs M. Validation therapy for dementia (Cochrane Review). In The Cochrane Library. Oxford: Update Software, 2002; Issue 4.
98. Feil N. The validation breakthrough. Simple techniques for communicating with people with ‘Alzheimer’s-Type Dementia’. Baltimore: Health Professions Press, 1993.
99. Feil N, Altman R. Validation theory and the myth of the therapeutic lie. Am J Alzheimers Dis Other Demen, 2004; 19: 77-8.
100. Woodrow P. Interventions for confusion and dementia. 4: Alternative approaches. Br J Nurs, 1998; 7: 1247-50.
101. Janssen JA, Giberson DL. Remotivation therapy. J Gerontol Nurs, 1988; 14: 31-4.
102. Sullivan FR, Bird ED, Alpay M, Cha JH. Remotivation therapy and Huntington’s disease. J Neurosci Nurs, 2001; 33: 136-42.
103. Petit J, Gaya P, Casals A. La atención psicológica a la familia en las demencias y en la enfermedad de Alzheimer. En Deví J, Deus J, editores. Las demencias y la enfermedad de Alzheimer: una aproximación práctica e interdisciplinar. Barcelona: Isep Universidad, 2004: 637-655.
104. Mittelman MS, Ferris SH, Shulman E, Steinberg G, Levin B. family intervention to delay nursing home placement of patients with Alzheimer disease. A randomized controlled trial. JAMA, 1996; 276: 1725-31.
105. Mittelman MS, Ferris SH, Shulman E, et al. A comprehensive support program: effect on depression in spouse-caregivers of AD patients. Gerontologist, 1995; 35: 792-802.
106. Marriot A, Donaldson C, Tarrier N, Burns A. Effectiveness of cognitive-behavioural family intervention in reducing the burden of care in carers of patients with Alzheimer’s disease. Br J Psychiatry, 2000; 176: 557-62.
107. Haupt M, Karger A, Janner M. Improvement of agitation and anxiety in demented patients after psychoeducative group intervention with their caregivers. Int J Geriatr Psychiatry, 2000; 15: 1125-9.
108. Folstein MF, Folstein SE, McHugh PR. Mini-mental state: a practical method for grading the cognitive state of patients for the clinician. J Psychiatric Res, 1975; 12: 189-198.
109. Lobo A, Escoba V, Exquerra J, Sevar-Díaz A. El Mini-Examen Cognoscitivo: un test sencillo, práctico, para detectar alteraciones intelectuales en pacientes psiquiátricos. Actas Luso Españolas de Neurología, Psiquiatría y Ciencias Afines, 1979; 3: 189-202.
110. Reisberg B, Ferris SH, de León MJ, Crook T. The global deterioration scale for assessment of primary degenerative dementia. Am J Psychiat, 1982; 139: 1136-1139.
111. Blessed G, Tomlinson BE, Roth M. The association between quantitative measures of dementia and of senile change in the cerebral grey matter of elderly subjects. Brit J Psychiat, 1968; 114: 797-811.
112. Yesavage JA, Brink TL, Rose TL, et al. Development and validation of a geriatric depression screening scale: a preliminary report. J Psychiatric Res, 1983; 17: 37-49.
113. Baltes MM, Kuhl KP, Gutzmann H, Sowarka D. Potential of cognitive plasticity as a diagnostic instrument: a cross-validation and extension. Psychol Aging, 1995; 10: 167-72.
114. Baltes MM, Kuhl KP, Sowarka D. Testing for limits of cognitive reserve capacity: a promising strategy for early diagnosis of dementia? J Gerontol, 1992; 47: 165-7.
115. Llinás J, Vilalta J, López-Pousa S. CAMDEX: adaptación y validación españolas. Barcelona: Áncora, 1991.
116. Peña-Casanova J, Aguilar M, Bertrán-Serra I, et al. y grupo NORMACODEM. Normalización de instrumentos cognitivos y funcionales para la evaluación de la demencia (NORMACODEM)(I): objetivos, contenidos y población. Neurología, 1997; 12: 61-68.
117. Peña-Casanova J, Aguilar M, Santacruz P, et al y grupo NORMACODEM. Adaptación y normalización españolas de la Alzheimer’s disease assessment scale (ADAS) (NORMACODEM)(II). Neurología, 1997; 12: 69-77.
118. Weschler D. Weschler memory scale manual. San Antonio: The Psychological Corporation, 1974.
119. SPSS. SPSS for Windows, Version 10. Chicago, IL: SPSS, 2001.